Struktur, sifat, penggunaan dan risiko ammonium asetat

- 4716
- 473
- Horace Gulgowski
Dia Ammonium asetat Ia adalah garam bukan organik yang formula kimia adalah NH4Ch3COOH. Ia berasal dari campuran asid asetik, hadir dalam cuka komersial hingga kepekatan 5%, dan ammonia. Kedua-dua bahan permulaan mempunyai bau ciri, jadi mungkin untuk mendapatkan idea mengapa garam ini berbau seperti cuka-amonia.
Walau bagaimanapun, yang paling menyerlahkan garam ini bukan bau, tetapi titik lebur yang rendah. Sangat rendah, di mana -mana makmal ia dapat diperolehi dalam versi cecairnya, di mana ion mengalir dengan bebas untuk mengangkut beban elektrik.
 Kristal ammonium asetat. Sumber: Volak [Domain Awam].
Kristal ammonium asetat. Sumber: Volak [Domain Awam]. Sebaliknya, ammonium asetat adalah lazat; iaitu, menyerap air atau kelembapan alam sekitar sehingga dibubarkan sepenuhnya. Itulah sebabnya, walaupun dalam keadaan anhydrous kristal mereka putih, mereka bertukar cerah (seperti yang ada di bikar imej atas).
Menjadi sumber ammonia yang kukuh, ia mesti dimanipulasi sedemikian rupa sehingga penyedutan wapnya diminimumkan. Tetapi, walaupun ciri -ciri negatif ini, NH4Ch3COOH berguna untuk penyediaan penyelesaian penampan yang dikekalkan makanan, sementara itu adalah komponen pengekstrak protein pelarut tertentu.
[TOC]
Struktur ammonium asetat
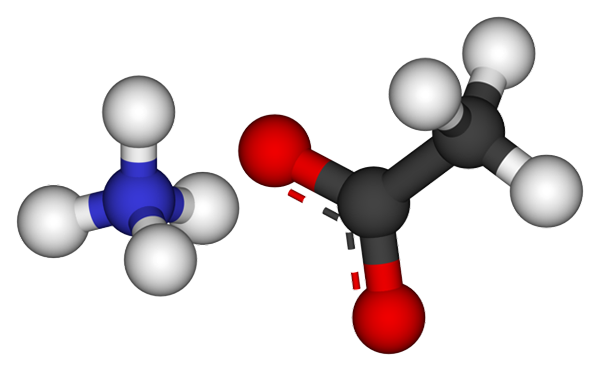 Ion ammonium asetat. Sumber: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Ion ammonium asetat. Sumber: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Imej atas menunjukkan ion yang membentuk ammonium asetat dalam model sfera dan bar. Di sebelah kiri adalah kation geometri tetrahedral, NH4+, Semasa di sebelah kanan anda, anion molekul dengan dua elektron yang diturunkan antara dua atom oksigen, CH3COO- (Garis putus -putus antara sfera merah).
Oleh itu, kedua -dua ion, NH4+ dan ch3COO-, Mereka tetap bersatu dengan tarikan elektrostatik mereka yang, bersama -sama dengan penolakan antara beban yang sama, akhirnya menentukan kristal. Kristal ammonium asetat ini mempunyai struktur ortorrombik, yang dapat dilihat dalam sampel mikroskopik atau bahkan saiz yang dapat dilihat.
Boleh melayani anda: pautan ionik: ciri -ciri, bagaimana ia terbentuk dan contohnyaBukan sahaja ikatan ionik untuk garam ini penting, tetapi begitu juga jambatan hidrogen. NH4+ Anda boleh mendermakan sehingga empat jambatan ini; Iaitu, di setiap simpul tetrahedronnya terdapat atom oksigen dari cho3COO- jiran (h3N+-H-Och3).
Secara teori, daya di dalam kristal mereka kemudiannya sangat kuat; Tetapi secara eksperimen bertentangan berlaku, kerana ia mencairkan hanya 114 ° C. Oleh itu, jambatan hidrogen tidak mengimbangi kelemahan ikatan ionik mereka, atau tenaga reticular yang rendah dari kaca ortorrombik NH4Ch3COO.
Komposisi dan air lain
Dikatakan pada mulanya bahawa ammonium asetat disediakan dengan mencampurkan aset dan asid ammonia. Oleh itu, garam juga boleh dinyatakan sebagai: NH3Ch3COOH. Oleh itu, bergantung kepada komposisi, struktur lain boleh diperolehi: NH3· 2ch3COOH, O NH3· 5ch3COOH, sebagai contoh.
Ia juga disebutkan bahawa ia menyerap kelembapan yang cukup. Dengan berbuat demikian, ia menggabungkan molekul air ke kristalnya, yang dihidrolisis memberikan NH3 atau ch3COOH; Dan itulah sebabnya garam memancarkan bau ammonia atau cuka.
Sifat
Penampilan fizikal
Kristal putih yang lebih baik dengan bau cuka dan ammonia.
Jisim molar
77,083 g/mol.
Ketumpatan
1,073 g/ml pada 25ºC.
Takat lebur
114ºC. Nilai ini jauh lebih rendah berbanding garam atau sebatian ionik yang lain. Di samping itu, ia tidak mempunyai titik mendidih kerana pembentukan ammonia, menyiratkan penguraian garam.
Kelarutan
143 g/100 ml pada 20ºC. Perhatikan kelarutan air yang luar biasa anda, yang menunjukkan pertalian yang dirasakan oleh molekul air pada ion NH4+ dan ch3COO-, Hying mereka dalam bidang berair.
Boleh melayani anda: Peraturan Hume-RotheryKelarutannya tidak begitu dalam pelarut kutub yang kurang. Sebagai contoh, dalam 100 ml metanol pada 15ºC 7.89 g NH dibubarkan4Ch3COO.
Kestabilan
Ia sedap, jadi anda harus mengelakkan menyimpan di ruang basah. Juga, semasa menyerap air membebaskan ammonia, dan oleh itu, ia terurai.
PKA
9.9.
Pemalar ini sepadan dengan keasidan ion ammonium:
NH4+ + B nh3 + Hb
Di mana hb adalah asid lemah. Jika asas B adalah air, tindak balas hidrolisisnya akan menjadi tindak balas:
NH4+ + H2Atau NH3 + H3Sama ada+
Di mana spesies h3Sama ada+ Tentukan pH penyelesaian.
Sebaliknya, asetat juga menyumbang kepada pH:
Ch3COO- + H2Atau ch3COOH + OH-
Oleh itu, kedua -dua spesies h3Sama ada+ Dan oh- Mereka dinetralkan dengan memberikan pH 7, neutral. Walau bagaimanapun, menurut PubChem, penyelesaian ammonium asetat yang sangat tertumpu mempunyai pH berasid; yang bermaksud bahawa hidrolisis NH mendominasi4+ Mengenai pilihan3COO-.
Entalpi latihan standard
ΔFH298 = -615 kJ/mol.
Aplikasi
Analisis
Penyelesaian natrium asetat berair membolehkan sulfat plumbum, besi dan zink untuk diselesaikan, seterusnya menentukan kepekatannya dengan spektroskopi penyerapan atom.
Separuh pemandu
Sebagai makanan suhu rendah berbanding garam lain, cecairnya boleh digunakan untuk memandu arus elektrik yang menghidupkan litar mentol.
Penampan
Anda boleh mengawal perubahan pH dalam selang berasid atau asas, yang digunakan untuk mengekalkan pH yang tetap, contohnya, daging, coklat, keju, sayur -sayuran atau produk makanan lain.
Boleh melayani anda: molibdenumDi atas ais dan lantai
Ia adalah garam yang boleh terbiodegradasi dan agak murah, digunakan untuk menghancurkan jalan berais. Juga, kerana ia adalah sumber nitrogen larut air, ia bertujuan untuk kegunaan pertanian untuk penentuan tahap kalium.
Ejen Precipitating
Garam ini digunakan untuk mendakan protein untuk melakukan analisis kromatografi.
Ubat
Ammonium acetate berfungsi sebagai ejen diuretik veterinar, dan ia juga garam yang diperlukan untuk sintesis insulin dan penisilin.
Risiko
Seterusnya dan akhirnya beberapa risiko negatif atau akibat yang disebabkan oleh ammonium asetat disenaraikan:
- Ia dapat menghasilkan sedikit kerengsaan pada kulit, tetapi tanpa menyerap di dalamnya.
- Apabila ditelan menyebabkan perut, cirit -birit, diuresis, kecemasan, keperluan yang lebih besar untuk membuang air kecil, gegaran dan gejala lain yang berkaitan dengan keracunan ammonia, serta merosakkan hati.
- Penyedutannya menjengkelkan hidung, tekak dan paru -paru.
Selebihnya, tidak diketahui jika kanser dapat menjana, dan kemungkinan risiko kebakaran oleh garam ini dibuang (sekurang -kurangnya di bawah keadaan penyimpanan biasa).
Rujukan
- InGer Nahringbauer. (1967). Kajian ikatan hidrogen. Xiv. Struktur kristal ammonium asetat. Institut Kimia, Universiti Uppsala, Uppsala, Sweden. Cryst Act. 23, 956.
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Ammonium asetat. Pangkalan data PUBCHEM. CID = 517165. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Sullivan Randy. (2012). Kekonduksian ammonium asetat. Pulih dari: chemdemos.Uoregon.Edu
- ViaChem, Ltd. (s.F.). Ammonium asetat. Pulih dari: ViaCheminc.com
- Wikipedia. (2019). Ammonium asetat. Diperoleh dari: dalam.Wikipedia.org
- Jabatan Kesihatan New Jersey. (2012). Ammonium Acetate: Lembaran Maklumat mengenai Bahan Berbahaya. [Pdf]. Pulih dari: NJ.Gov
- Xueyanghu. (s.F.). Kegunaan dan risiko ammonium asetat. Pulih dari: xueyanghu.WordPress.com
- « Ciri -ciri Alizarin, Penyediaan, Kegunaan dan Ketoksikan
- Struktur hidroksida (iii) besi, sifat dan kegunaan »

