Struktur, sifat, sintesis natrium, kegunaan sodium acetate

- 716
- 146
- Ms. Micheal Rippin
Dia natrium asetat Ia adalah garam natrium asid asetik yang formula molekulnya adalah c2H3Sama ada2Na. Ia terdiri daripada serbuk putih yang lazat, yang terdapat pada dua bentuk: anhydrous dan trihydrate. Kedua -duanya sangat larut dalam air, pelarut sejagat; Tetapi tidak begitu larut dalam alkohol atau aseton.
Bentuk anhydra mempunyai ketumpatan, titik gabungan dan mendidih dengan nilai yang lebih tinggi daripada yang dibentangkan oleh bentuk trihydrate natrium asetat. Ini kerana molekul air mengganggu antara interaksi ion na+ dan ch3COO-.
 Penampilan natrium asetat
Penampilan natrium asetat Natrium asetat stabil, terutamanya jika ia disimpan antara 2 dan 8 ºC; Tetapi ia terdedah kepada tindakan agen pengoksidaan yang kuat dan halogen.
Ia boleh disediakan oleh tindak balas natrium bikarbonat dengan asid asetik. Juga, dengan tindak balas asid asetik dengan natrium hidroksida. Kedua -dua tindak balas adalah mudah untuk menghuraikan kos ekonomi dan rendah; Yang pertama juga boleh dilakukan di rumah.
Garam ini adalah sebatian toksik sedikit. Menghasilkan kerengsaan kulit, hanya selepas hubungan yang kerap dan berterusan. Ia sedikit menjengkelkan untuk mata tetapi dapat merengsakan saluran udara. Tidak ada maklumat mengenai kesan berbahaya dari pengambilan anda.
Ia mempunyai banyak kegunaan dan aplikasi, menonjolkan fungsi redaman pH, bersama -sama dengan asid asetik. Penyerap kejutan asetat mempunyai PKA = 4.7; yang memberikan kecekapan yang tinggi dalam peraturan pH dalam persekitaran berasid dengan nilai pH antara 3 dan 6.
Oleh kerana ketoksikan yang rendah dan sifatnya, ia telah digunakan secara meluas untuk meningkatkan rasa makanan, serta ejen yang memberikan perlindungan terhadap penguraian mereka kerana tindakan mereka terhadap mikroba.
[TOC]
Struktur natrium asetat
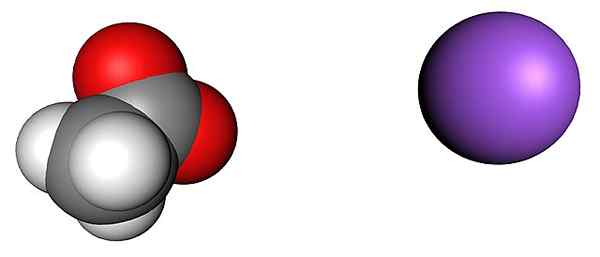 Ion asetat dan natrium. Sumber: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Ion asetat dan natrium. Sumber: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Imej atas menunjukkan ion yang membentuk kristal natrium asetat anhydrous (tanpa air). Sfera ungu sepadan dengan kation na+, Dan ion molekul ke kirinya adalah acetate, cho3COO-, Dengan atom oksigen yang diwakili oleh sfera merah.
Rakan sebaya ini, menurut cip ch3Jalan, berada dalam perkadaran 1: 1; Untuk setiap cho3COO-, Mesti ada kation+ tertarik dengan beban negatifnya dan sebaliknya. Oleh itu, tarikan di antara mereka, dan penolakan antara beban yang sama, akhirnya mewujudkan corak struktur yang menentukan kristal, yang ekspresi minimum adalah sel kesatuan.
Sel kesatuan ini, seperti kaca secara keseluruhan, berbeza -beza bergantung kepada pelupusan ion di ruang angkasa; Ia tidak selalu sama, walaupun untuk sistem kristal yang sama. Sebagai contoh, natrium asetat anhydrous boleh membentuk dua polimorf ortorrombik, salah satunya diwakili di bawah:
 Sel kesatuan kristal ortorrombik natrium asetat. Sumber: Benjah-bmm27 [domain awam]
Sel kesatuan kristal ortorrombik natrium asetat. Sumber: Benjah-bmm27 [domain awam] Perhatikan susunan ion: empat ion cho3COO- Mereka melampirkan na+ sedemikian rupa sehingga mereka "menarik" piramid asas persegi yang diputarbelitkan. Setiap Cho ini3COO- seterusnya berinteraksi dengan na yang lain+ bersebelahan.
Kristal terhidrat
Natrium asetat mempunyai banyak pertalian untuk air; Sebenarnya ia lazat, iaitu, ia mengekalkan kelembapan sehingga ia dibubarkan dengan yang sama. Semakin besar kelembapan, lebih cepat ia adalah "cair". Ini kerana begitu3COO- Seperti na+ Mereka boleh menghidrat, mengelilingi diri dengan molekul air yang membimbing dipoles ke arah beban mereka (Na+ Oh2, Ch3COO- Hoh).
Boleh melayani anda: bromida perak (AGBR): struktur, sifat dan kegunaanApabila garam ini disediakan di makmal atau di rumah, ia adalah satu pertalian untuk air yang walaupun pada suhu normal telah diperolehi sebagai hidrat; ch3Pata · 3h2Sama ada. Kristal mereka berhenti menjadi ortorrombik dan menjadi monoklinik, kerana mereka kini menggabungkan tiga molekul air untuk setiap pasangan cho3COO- dan na+.
Sifat
Nama
-Natrium asetat.
-Natrium etanoat (IUPAC).
Jisim molar
-Anhydrous: 82.03 g/mol.
-Trihydrated: 136.03 g/mol.
Aspek
Serbuk putih yang lebih baik.
Bau
Cuka ketika dia dipanaskan untuk penguraian.
Ketumpatan
-Anhidro: 1, 528 g/cm3 pada 20 ºC.
-Trihydrated: 1.45 g/cm3 pada 20 ºC.
Takat lebur
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydrate: 58 ºC (136 ºF, 331 K).
Takat didih
-Anhidro: 881.4 ºC (1.618.5 ºF, 1.154.5 k).
-Trihydrate: 122 ºC (252 ºF, 395 K). Ia terurai.
Kelarutan
Dalam air
-Anhydro: 123.3 g/100 ml pada 20ºC.
-Trihydrated: 46.4 g/100 ml pada 20 ºC.
Dalam metanol
16 g/100 g pada 15 ºC.
Dalam etanol
5.3 g/100 ml (Trihydrate).
Dalam aseton
0.5 g/kg pada suhu 15 ° C.
Keasidan
PKA: 24 (20 ºC).
Asas
PKB: 9.25. Di sini jelas bahawa natrium asetat adalah garam asas kerana perlu mempunyai pkb kurang daripada pka.
Indeks Pembiasan (ηd)
1,464
Kapasiti kalori
-100.83 J/mol · K (anhydrous).
-229.9 J/mol · K (Trihydrado).
titik pencucuhan
Lebih 250ºC.
Suhu sendiri
600 ºC.
Ph
8.9 (penyelesaian 0.1 m hingga 25 ºC).
Kestabilan
Stabil. Tidak serasi dengan ejen pengoksidaan yang kuat dan halogen. Kelembapan.
Reaksi
Natrium asetat boleh membentuk ester dengan bertindak balas dengan halida sewa; Sebagai contoh, Bromoetano:
Ch3Poron +Brch2Ch3 => Ch3Cooch2Ch3 + NABR
Natrium asetat adalah decarboxyla untuk membentuk metana (pirolisis) dengan kehadiran NaOH:
Ch3Poon +naOH => ch4 + Na2Co3
Tindak balasnya dipangkin oleh jualan cesio.
Sintesis
Natrium asetat boleh dihasilkan dengan kos rendah di makmal dengan bertindak balas natrium bikarbonat dengan asid asetik:
Nahco3 + Ch3Cooh => ch3Jalan +h2Co3
Reaksi ini disertakan dengan kehadiran dalam larutan gelembung yang sengit, disebabkan oleh penguraian asid karbonik dalam air dan karbon dioksida.
H2Co3 => H2Atau +co2
Secara industri, natrium asetat dihasilkan oleh tindak balas asid asetik dengan natrium hidroksida.
Ch3COOH +NaOH => CH3Jalan +h2Sama ada
Aplikasi
Beg termal
Natrium asetat digunakan untuk pembuatan beg terma.
Pada mulanya, kristal garam dibubarkan dalam jumlah air untuk penyediaan penyelesaian yang menjadi supersaturated.
Kemudian penyelesaian pada suhu lebih besar daripada 58 ºC dipanaskan, iaitu titik leburnya. Penyelesaian supersaturated pada suhu bilik dibenarkan untuk menyejukkan dan pembentukan kristal tidak dipatuhi; Penyelesaiannya berakhir -chirp.
Boleh melayani anda: jadual berkala, untuk apaKetiadaan kristal dijelaskan bahawa molekul cecair terlalu kemas dan tidak mempunyai panduan yang sewajarnya untuk mencapai suhu penghabluran. Cecair berada dalam keadaan metastable, keadaan ketidakseimbangan.
Memberi. Dalam kes beg haba, lampiran mekanikal ditekan untuk menggerakkan cecair dan memulakan pembentukan kristal dan pemejalan larutan natrium asetat trihydrated.
Apabila penghabluran berlaku, suhu meningkat. Kristal natrium asetat trihydrated memperoleh penampilan ais, tetapi mereka panas, jadi ia dipanggil "ais panas".
Industrialis
-Natrium asetat digunakan dalam industri tekstil sebagai mordan dalam proses pewarnaan tisu
-Meneutralkan sisa asid sulfurik
-Ia telah digunakan dalam pemprosesan kapas untuk penjelasan pad kapas, boleh digunakan dalam pembersihan peribadi dan untuk tujuan perubatan
-Ia digunakan dalam pickling logam, sebelum kromnya
-Berkolaborasi supaya pembubaran chloroprene tidak berlaku dalam proses pengeluaran getah sintetik
-Campur tangan dalam penyucian glukosa
-Ia digunakan dalam penyamakan kulit.
Penggunaan perubatan
Natrium asetat adalah sebahagian daripada sebatian yang digunakan untuk membekalkan elektrolit yang diberikan kepada pesakit secara intravena.
Ia digunakan untuk membetulkan paras natrium pada pesakit hiponatemik, juga dalam pembetulan asidosis metabolik dan alkalinasi air kencing.
Penyelesaian redaman pH
Ia digunakan sebagai pengawal selia pH dalam banyak reaksi enzimatik yang berlaku antara pH 3 dan pH 6.
PH yang berbeza dari larutan penampan asetat dicapai oleh variasi kepekatan asid asetik dan natrium asetat.
Sebagai contoh, untuk mendapatkan pH 4.5 penyelesaian penampan mempunyai kepekatan asid asetik 3.8 g/L dan kepekatan natrium anhydrous asetat 3.0 g/l.
Kepekatan penyelesaian penampan asetat dapat ditingkatkan, meningkat dalam perkadaran yang sama komponen penyelesaian yang diperlukan untuk mendapatkan pH yang dikehendaki.
Penyerap kejutan acetate/acetonitrile digunakan dalam elektroforesis kapilari dalam pemisahan photeberberine.
Makmal penyelidikan
-Natrium asetat adalah agen nukleofilik yang lemah yang digunakan dalam pempolimeran anionik β-lakton.
-Ia digunakan sebagai reagen dalam resonans magnetik nuklear makromolekul biologi.
-Ia digunakan dalam pengekstrakan sel sel. Natrium adalah kation yang berinteraksi dengan beban negatif fosfat yang terdapat dalam DNA, yang membantu dalam pemeluwapannya. Di hadapan etanol, DNA membentuk endapan yang kemudiannya boleh dipisahkan ke dalam lapisan berair.
Pemuliharaan makanan
-Ia membantu mencegah pertumbuhan bakteria, sebagai tambahan untuk mencegah penjanaan keasidan yang berlebihan yang menyebabkan kemerosotan makanan, dengan itu mengekalkan pH tertentu.
-Natrium yang hadir dalam asetat meningkatkan rasa makanan.
-Natrium asetat digunakan dalam penyediaan acar sayuran: timun, lobak merah, bawang, dll. Di samping itu, ia digunakan dalam pemuliharaan daging.
Boleh melayani anda: dimethylanlin: struktur, sifat, sintesis, kegunaanPemuliharaan konkrit
Konkrit rosak oleh tindakan air yang memendekkan tempohnya. Natrium asetat bertindak sebagai agen sealant konkrit yang kalis airnya ke air, memanjangkan ciri awalnya.
Eksperimen muda
Eksperimen 1
Percubaan mudah adalah sintesis natrium asetat melalui tindak balas natrium bikarbonat dengan cuka (5%asid asetik).
30 ml cuka diletakkan di dalam bikar dan kira -kira 3.5 g bikarbonat ditambah.
Dalam reaksi natrium dan bentuk asid karbonik terbentuk. Asid dipecah menjadi karbon dioksida dan air. Generasi karbon dioksida akan menghasilkan gelembung yang sengit dalam penyelesaiannya.
Untuk mengumpul natrium asetat, penyejatan air disebabkan, memanaskan penyelesaiannya.
Eksperimen 2
Satu lagi percubaan mudah ialah pembentukan natrium trihydrate acetate.
Untuk melakukan ini, sekitar 20 g trihydrate natrium asetat dan diletakkan di dalam bikar, kemudian menambah 10 ml air, kemudian menambah 10 ml air. Penyelesaiannya dipanaskan ke suhu lebih besar daripada 58 ºC.
Natrium asetat dibubarkan sepenuhnya untuk memastikan penyelesaiannya disegarkan. Sebelum ini, kapsul Pietri diletakkan di permukaan sejuk.
Kandungan bikar dengan trihydrate acetate dalam kapsul Pietri perlahan -lahan dituangkan. Suhu cecair dalam kapsul mula turun, walaupun di bawah titik lebur, tanpa mengamati penghabluran atau pemejalan natrium asetat trihidrat.
Biasanya untuk menghasilkan penghabluran natrium asetat trihidrasi, sedikit garam ditambah untuk berfungsi sebagai teras penghabluran. Pada masa lain terdapat gangguan kecil penyelesaian, untuk memulakan penghabluran natrium asetat.
Kristal natrium asetat trihydrated kelihatan seperti ais, tetapi jika mereka disentuh, ia akan diperhatikan bahawa mereka agak panas. Atas sebab ini, garam dipanggil "ais panas".
Ketoksikan
Natrium asetat adalah sebatian toksik yang sangat sedikit. Ia juga tidak dikelaskan sebagai pemekaan untuk kulit dan saluran udara.
Di samping itu, natrium asetat tidak diklasifikasikan sebagai agen mutagenik dalam sel kuman, karsinogen atau toksik untuk pembiakan.
Pendek kata, ia sedikit menjengkelkan untuk mata. Saluran pernafasan dapat direngsa setelah penyedutan mereka. Hubungan yang kerap dan berterusan dengan kulit boleh menyebabkan kerengsaannya.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Dunia Kotak. (16 Januari 2017). Cara menyediakan natrium asetat di rumah? Pulih dari: sederhana.com
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Natrium asetat. Pangkalan data PUBCHEM. CID = 517045. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- S. Cameron, k. M. Mannan dan m. Sama ada. Rahman. (1976). Struktur kristal trihydrate natrium asetat. Cryst Act. B32, 87.
- Wikipedia. (2019). Natrium asetat. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (24 Januari 2019). Buat ais panas dari cuka dan baking soda. Pulih dari: Thoughtco.com
- Buku Kimia. (2017). Natrium asetat. Pulih dari: buku kimia.com
- Wasserman Robin. (2019). Penggunaan natrium asetat. Pulih dari: livestrong.com
- DrugBank. (2019). Natrium asetat. Pulih dari: Drugbank.Ac

