Ciri -ciri Alanina, Struktur, Fungsi, Biosintesis
- 2506
- 237
- Horace Gulgowski
The kepada gadis itu (Sayap) adalah salah satu daripada 22 asid amino yang diketahui yang membentuk struktur protein semua organisma, dari bakteria hingga lelaki. Oleh kerana organisma dapat mensintesis, ini diklasifikasikan sebagai asid amino yang tidak penting.
Protein mempunyai struktur asas atau primer yang terdiri daripada rantai asid amino yang dipanggil rantai polipeptida, dalam rantai setiap asid amino dibentuk oleh karbon pusat yang dipanggil karbon α.
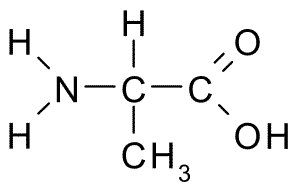
 Struktur Kimia Asid Amino Alanine (Sumber: Borb, melalui Wikimedia Commons)
Struktur Kimia Asid Amino Alanine (Sumber: Borb, melalui Wikimedia Commons) Karbon α menyertai empat kumpulan: kumpulan amino (-NH2), kumpulan karboksil (-COH), atom hidrogen (-H) dan kumpulan atau rantaian sampingan (-R) yang mengenal pasti setiap asid amino. Di rantaian sampingan, karbon berurutan mengambil huruf ß, γ, δ dan ε.
Asid amino diklasifikasikan oleh polaritas rantai sampingan mereka dan oleh itu terdapat asid amino polar hidrofobik dan hidrofilik yang seterusnya boleh menjadi neutral, asas dan berasid. Alanine adalah asid amino apolar hidrofobik dan asid amino yang paling mudah selepas gliserin dan yang paling banyak di kebanyakan protein.
Alanine boleh dibentuk di otot dan diangkut ke hati, di mana ia diperkenalkan ke laluan glukoneogenik, iaitu, laluan untuk pembentukan glukosa dari bahan bukan glukosid. Alanine juga boleh disintesis di hati melalui katabolisme tryptophan dan uracil dan dapat merendahkan untuk membentuk piruvat.
Mengambil bahagian dalam sintesis tryptophan, pyridoxin (vitamin B6) dan daging.
Ia digunakan sebagai makanan tambahan untuk meningkatkan prestasi sukan dan secara semula jadi dijumpai dalam daging lembu, daging babi dan daging, serta susu dan derivatif dan telurnya. Beberapa kekacang, buah -buahan dan kacang juga kaya dengan alanin.
[TOC]
Struktur
Sebelum ini, Alanine, seperti semua asid amino, mempunyai karbon α dengan empat kumpulan yang bersatu padanya, sebagai kumpulan R metil (-CH3).
Oleh itu, ke pH badan (sekitar 7.4) Karbon α alanine dikaitkan dengan kumpulan proton amino (-NH3+), kepada kumpulan karboksil yang telah kehilangan proton (-co-), kepada hidrogen dan kumpulan metil (-CH3).
Sebilangan besar asid amino boleh diionkan ke pH 7.0 dan secara geometri mereka boleh mempunyai isomer, yang dikenali sebagai enantiomer, yang merupakan imej spekular, seperti tangan kanan dan kiri.
Boleh melayani anda: histokimia: asas, pemprosesan, pewarnaanKemudian, semua asid amino boleh didapati sebagai "pasangan kiral" yang dilambangkan sebagai d atau l (dextro dan levo, masing -masing), mengikut kedudukan atom -atom yang mengelilingi karbon α.
Walau bagaimanapun, alanine, seperti kebanyakan asid amino.
Asid amino ini juga boleh didapati sebagai β-alanine, di mana kumpulan amino dilampirkan pada karbon βnya, iaitu, karbon pertama rantai sampingannya.
Β-alanine didapati dalam asid pantotenik (vitamin B5) dan dalam beberapa peptida semulajadi. D-alanine ditemui dalam beberapa polipeptida yang merupakan sebahagian daripada dinding beberapa sel bakteria.
Kumpulan R (Metilo, CH3)
Metil rantai sisi alanine adalah hidrokarbon tepu yang memberikan ciri hidrofobik apolar kepada asid amino ini. Ciri -ciri alanine ini adalah biasa dengan asid amino lain kumpulan ini seperti gliserin, valine, leucine dan isoleucine.
Asid amino yang membentuk kumpulan alifatik adalah asid amino neutral kimia dan memainkan peranan yang sangat penting dalam pembentukan dan penyelenggaraan struktur tiga dimensi protein kerana mereka mempunyai kecenderungan untuk bertindak balas antara satu sama lain tidak termasuk air.
Asid amino ini, termasuk alanine, mengandungi bilangan kumpulan yang sama dengan beban yang bertentangan, jadi mereka tidak mempunyai beban bersih dan dipanggil "Zwitterions ".
Fungsi
Seperti asid amino yang paling diketahui, alanine digunakan dalam sintesis peptida dan protein secara umum, dan mengambil bahagian dalam penubuhan struktur polipeptida dan dalam struktur tersier beberapa protein.
Satu lagi fungsi penting Alanine adalah untuk mengambil bahagian secara tidak langsung dalam kawalan glikemia:
Ia dapat menimbulkan piruvat dan sebaliknya, ia juga dapat mencapai hati dan menjadi glukosa melalui gluconeogenesis untuk dilihat untuk peredaran atau digunakan dalam sintesis glikogen, sebagaimana perlu.
Alanine mengambil bahagian sebagai pengangkut ammonium dari otot ke hati, kerana ia dapat disintesis dengan aminasi dari piruvat, mengangkut hati dan ada transaminasi dengan transaminasi.
Ini berlaku bersamaan dengan transformasi α-zotoglutarate kepada glutamat, yang boleh memasuki kitaran urea dan menjadi piruvat.
Fungsi lain
Asid amino ini sangat diperlukan untuk sintesis tryptophan dan pyridoxin. Walaupun ia sangat reaktif secara kimia, alanine boleh mempunyai pengiktirafan substrat dan pengiktirafan peraturan enzimatik.
Boleh melayani anda: kumpulan paraphiletikSalah satu fungsi β-alanine adalah makanan tambahan, kerana ia digunakan sebagai bantuan ergogenik latihan. Pengambilan β-alanine meningkatkan kepekatan daging (dipéptida yang dibentuk oleh β-alanine dan histidine) dalam otot rangka, bertindak sebagai "Penampan ".
Biasanya, daging tidak menyumbang dengan ketara kepada jumlah kapasiti penampan sel otot dan ini disebabkan oleh kepekatannya yang rendah. Pentadbiran β-alanine meningkatkan kepekatan ini dan oleh itu kapasiti penampan, jadi ia meningkatkan rintangan dengan mengurangkan keletihan.
Biosintesis
Sintesis alanin yang paling penting dalam tubuh manusia berlaku oleh pengauditan asid piruvik yang reduktif. Reaksi ini memerlukan satu langkah enzimatik.
Pyruvate menyediakan rangka karbon dan glutamat menyediakan kumpulan amino yang dipindahkan ke piruvat. Enzim yang memangkinkan tindak balas yang boleh diterbalikkan ini adalah alanine transaminase.
Hasil daripada tindak balas ini, alanine dan α-cetoglutarate dihasilkan. Alanine kemudiannya boleh hadir dalam glukoneogenesis, glikolisis dan dalam kitaran Krebs.
Satu lagi sumber alanine berasal dari kemerosotan tryptophan ke acetyl-CoA. Pada laluan ini, apabila enzim quinureninase hidrolis. Alanine dibebaskan dan antranilasi 3-hidroksi mengikuti laluan metabolik.
Degradasi Uracil adalah sumber alanin lain. Dalam kes ini terdapat β-alanine yang boleh mengikuti beberapa laluan metabolik, salah satunya adalah untuk menjadi asetil-CoA.
Degradasi
Proses umum degradasi asid amino
Asid amino tidak disimpan sebagai karbohidrat dan lemak, jadi yang dikeluarkan semasa kemerosotan protein harus digunakan semula untuk sintesis protein dan nukleotida baru.
Sebaliknya, asid amino boleh dihina dan kerangka berkarbonat mereka boleh digunakan dalam reaksi katabolik atau anabolik.
Apabila asid amino dihina, bentuk ammonia nitrogen yang berlebihan, yang merupakan bahan toksik yang mesti dihapuskan dan langkah pertama degradasi asid amino adalah penghapusan nitrogen.
Dalam mamalia, degradasi ini berlaku di hati; Di sana, semua asid amino yang berlebihan dan tidak boleh digunakan adalah terdegradasi.
Degradasi alanine
Degradasi alanine berlaku oleh penukaran alanin ke piruvat. Tindak balas ini dikatalisis oleh transaminase alanine dan memerlukan kehadiran α-zotoglutarate sebagai penerima kumpulan amino dan pembentukan glutamat berikutnya; Ia adalah tindak balas yang boleh diterbalikkan.
Boleh melayani anda: faktor virulensiReaksi pembentukan alanine ini dari degradasi piruvat dan alanine untuk membentuk piruvat adalah sebahagian daripada kitaran yang melibatkan otot rangka dan hati.
Hati mengambil glukosa ke otot dan otot, melalui glikolisis, menukarkan glukosa menjadi piruvat untuk menghasilkan ATP; Pyruvate ini boleh memasuki sintesis alanine, yang boleh dituangkan ke dalam torrent peredaran dan kembali ke hati yang menjadikannya piruvat, yang memasuki gluconeogenesis untuk membentuk glukosa.
Sekiranya perlu kitaran diulang. Di hati, pengeluaran piruvat dari alanine menghasilkan ion ammonium yang melihat glutamin dan glutamat dan mereka memasuki kitaran urea. Maka urea dihapuskan oleh air kencing.
Alanin, glisin, sistein, serine dan treonin adalah asid amino glikogenik kerana kemerosotan mereka dapat menimbulkan piruvat, α-zetoglutarate, succinyl-CoA, kepada fumarate atau oxalacetate, semua prekursor gluconeogenik.
Makanan yang kaya dengan Alanina
Sumber utama asid amino adalah daging tanpa lemak, ikan, kerang, telur dan produk tenusu, bagaimanapun, alanine juga terdapat di banyak makanan asal tumbuhan. Contoh makanan yang kaya dengan Alanina adalah:
- Daging seperti lembu, daging babi, kambing biri -biri, ayam, ayam belanda, arnab, ikan; Telur, susu dan derivatif.
- Buah -buahan kering seperti hazelnut, kacang, buah berangan, badam dan kacang tanah adalah sumber alanina.
- Kelapa, alpukat, asparagus, terung, ubi kayu atau ubi kayu, bit, lobak merah dan ubi jalar.
- Kekacang seperti jagung, kacang dan kacang polong.
- Bijirin seperti beras, rai, gandum, koko, oat dan rai.
Rujukan
- Caruso, j., Charles, j., Unruh, k., Giebel, r., Leardonth, l., & Potter, w. (2012). Kesan ergogenik β-alanine dan carnosine: Cadangan penyelidikan masa depan untuk mengukur efficacy. Nutrien, 4(7), 585-601.
- Gille, c., Bölling, c., Hoppe, a., Bulik, s., Hoffmann, s., Hübner, k.,... Holzhütter, h. G. (2010). Hepatonet1: Pembinaan semula metabolik komprehensif hepatosit manusia untuk analisis fisiologi hati. Biologi Sistem Molekul, 6(411), 1-13.
- Mathews, c., Van holde, k., & Ahern, k. (2000). Biokimia (Edisi ke -3.). San Francisco, California: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, ms., Rodwell, v., & Weil, p. (2009). Biokimia Illustrated Harper (Edisi ke -28.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Prinsip Biokimia Lehninger. Edisi Omega (Edisi ke -5.).

