Alkenes
- 3519
- 296
- Kerry Schmitt
 Alkenes atau olefin adalah hidrokarbon tak tepu yang mempunyai sekurang-kurangnya ikatan karbon karbon berganda dalam struktur mereka
Alkenes atau olefin adalah hidrokarbon tak tepu yang mempunyai sekurang-kurangnya ikatan karbon karbon berganda dalam struktur mereka Apa itu Alkenes?
The Alkenes atau olefin Mereka adalah hidrokarbon tak tepu yang mempunyai sekurang -kurangnya ikatan berganda dalam struktur mereka. Mereka dipanggil olefin kerana keupayaan etene atau etilena untuk bertindak balas dengan halogen untuk menghasilkan minyak atau minyak. Pada masa ini, istilah olefinas telah tidak digunakan dan sebatian ini kini dipanggil alkenes.
Sifat fizikal alkena dipengaruhi oleh berat molekul mereka, serta kerangka berkarbonat mereka. Sebagai contoh, alkenes dengan 2 hingga 4 karbon (buteno etene) adalah gas. Dengan 5 hingga 18 atom karbon dalam rantai panjang adalah cecair. Sementara alkena dengan lebih daripada 18 atom karbon pepejal.
Kehadiran ikatan berganda memberikan kereaktifan yang hebat, dengan itu mengalami banyak tindak balas kimia, seperti penambahan, penghapusan, penghidrogenan, penghidratan dan pempolimeran, yang membolehkannya menghasilkan banyak kegunaan dan aplikasi.
Alkenes dihasilkan secara industri oleh retak haba berat molekul yang tinggi (lilin parafin); Dehidrogenasi pemangkin dan pengklorinan-dehydrocloclination.
Struktur kimia alkena
 Sumber: Diri Diri
Sumber: Diri Diri Alkenes dicirikan dengan mempunyai satu atau lebih pautan ganda dalam struktur mereka. Ini diwakili sebagai C = C, mempunyai kedua -dua atom karbon SP hibridisasi2.
Oleh itu, rantau rantai di mana ikatan berganda, atau tidak tepu, rata. Ia juga meritor untuk menunjukkan bahawa kedua -dua karbon itu boleh dikaitkan dengan dua substituen lain (atau kumpulan).
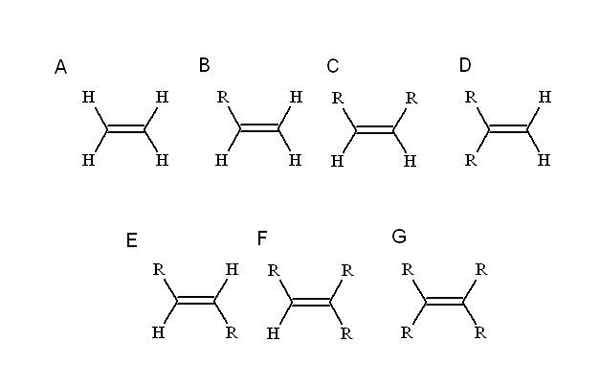
Substituen mana? Sesiapa yang menggantikan salah satu hidrogen alkena yang paling mudah: etilena (atau eteno). Bermula dari dia (a, imej unggul) r, yang merupakan substituen alquilic, menduduki tempat salah satu daripada empat hidrogen untuk menyebabkan alkena mono-substitute (b).
Setakat ini, tanpa mengira hidrogen diganti, identiti B tidak diubah. Ini bermakna ia tidak mempunyai stereoisomer, terdiri daripada formula kimia yang sama tetapi dengan pelupusan spatial yang berbeza dari atomnya.
Dapat melayani anda: titik kesetaraanStereoisomer
Apabila hidrogen kedua digantikan oleh R yang lain, seperti dalam C, kini stereoisomer C, D dan E. Ini kerana orientasi ruang berkenaan dengan kedua-dua R boleh berbeza-beza, dan untuk membezakan satu sama lain, tugas cis-trans atau e-z digunakan.
Di C, alkena di-substitut, kedua-dua r boleh menjadi rantai panjang atau beberapa heteroátomo. Satu berada di kedudukan hadapan berhubung dengan yang lain. Jika kedua-kedua terdiri daripada substituen yang sama, f, sebagai contoh, maka c adalah stereoisomer-cis.
Di D, kedua -dua kumpulan R lebih dekat, kerana ia dikaitkan dengan atom karbon yang sama. Ini adalah stereoisomer geminal, walaupun lebih daripada stereoisomer, ia sebenarnya adalah ikatan berganda terminal, iaitu, ia adalah pada akhir atau prinsip rantai (untuk sebab itu ia mempunyai dua hidrogen karbon lain).
Dan di E, yang paling stabil stereoisomer (atau isomer geometri), dua kumpulan r dipisahkan dengan jarak yang lebih besar, yang melintasi pepenjuru ikatan berganda. Mengapa yang paling stabil? Ini kerana kerana pemisahan ruang di antara mereka lebih besar, jadi tidak ada ketegangan kakak antara kedua -dua.
Sebaliknya, f dan g masing-masing adalah tri-dan tetra yang digegarkan. Sekali lagi, mereka tidak dapat menghasilkan stereoisomer.
Sifat fizikal dan kimia alkena
Kelarutan
Mereka tidak dapat dilepaskan dengan air kerana polaritas yang rendah. Tetapi mereka membubarkan pelarut organik.
Titik gabungan pada ºC
Etano -169, propeno -185, 1 -pentine -165, 1 -hepteno -119, 3 -Octein
-101.9, 3 -none -81.4 dan 5 -Dechenum -66,3.
Titik mendidih di º c
Etano -104, propeno -47, trans2buteno 0.9, cis2buteno 3,7, 1-penten 30, 1-hepteno 115, 3-ok 122, 3-noneno 147 dan 5-decend.
Boleh melayani anda: penapis makmal): Ciri, fungsi, jenisTitik mendidih meningkat dalam hubungan langsung dengan bilangan karbon alkena. Sebaliknya, lebih banyak bercabang strukturnya, yang paling lemah adalah interaksi intermolecularnya, yang dicerminkan dalam pengurangan titik mendidih atau gabungan.
Ketumpatan
Etano 0.6128 mg/ml, propeno 0.6142 mg/ml dan 1-butene 0.6356 mg/ml, 1-pente 0.64 mg/ml dan 1-hexen 0.673.
Dalam alkenes ketumpatan maksimum ialah 0.80 mg/ml. Iaitu, mereka kurang padat daripada air.
Polariti
Ia bergantung kepada struktur kimia, penggantian dan kehadiran kumpulan fungsi lain. Alkenes mempunyai dipmer, oleh itu isomer cis 2-butena.
Reaktiviti Alkenes
Alkenes mempunyai keupayaan besar untuk bertindak balas kerana pautan berganda yang mereka ada. Antara tindak balas yang terlibat ialah: penambahan, penghapusan, penggantian, penghidrogenan, penghidratan dan pempolimeran.
Reaksi tambahan
H2C = ch2 + Cl2 => Clch2-Cclh2 (Ethylene diklorida)
Tindak balas hidrogenasi
Ia berlaku pada suhu tinggi dan dengan kehadiran pemangkin yang mencukupi (PT, PD, atau dibahagikan dengan halus)
Ch2= Ch2 + H2 => Ch3-Ch3 (Etano)
Tindak balas penghidratan
Reaksi yang merupakan sumber penjanaan alkohol dari derivatif minyak:
H2C = ch2 + H2O => h3C-ch2Oh (etil alkohol)
Tindak balas pempolimeran
Etilena dengan kehadiran pemangkin seperti aluminium percubaan dan titanium tetrachloride polimeriza dalam polietilena, yang mengandungi kira -kira 800 atom karbon. Jenis polimer ini dipanggil polimer tambahan.
Kegunaan dan aplikasi alkenes
Polimer
- Polietilena ketumpatan rendah digunakan dalam pembuatan beg, plastik rumah hijau, pembungkusan, hidangan, kapal, dll. Walaupun ketumpatan tinggi lebih tegar dan tahan mekanikal, menggunakan dalam pembuatan kotak, perabot, pelindung seperti topi keledar dan lutut, mainan dan palet.
- Polipropilena, polimer propylene, digunakan dalam penjelasan bekas, kepingan, peralatan makmal, mainan, filem pembungkusan, filamen sogas, upholsteri dan permaidani.
- Polyvinyl chloride (PVC) adalah polimer vinil klorida yang digunakan dalam pembuatan tiub, jubin untuk lantai, saluran, pintu dan bingkai tingkap, dll.
- Polybutadiene, polimer 1.3-butadiena, bertujuan untuk pembuatan jalur galas, selang dan tali pinggang kenderaan, serta untuk salutan tin logam.
- Ethylene dan propylene copolymers digunakan dalam pembuatan hos, badan dan bahagian casis untuk tekstil, dll.
Alkenes
- Mereka digunakan untuk mendapatkan pelarut seperti etilena glikol dan dioksana. Ethylene Glycol digunakan sebagai antibeku dalam radiator kereta.
- Ethylene adalah hormon tumbuhan yang mengawal pertumbuhannya, percambahan benih dan perkembangan buah -buahan. Oleh itu, ia digunakan untuk mendorong pematangan pisang ketika mereka sampai ke destinasi mereka.
- Ia digunakan sebagai bahan mentah untuk pembuatan banyak sebatian seperti alkil halida, etilena oksida dan terutama etanol. Mereka juga menggunakan industri, penjagaan peribadi dan perubatan.
- Mereka digunakan dalam mendapatkan dan pembuatan lacquers, detergen, aldehid dan bahan api. 1.3-butadieno digunakan sebagai bahan mentah dalam pembuatan karet sintetik.
Rujukan
- Tugasan Kimia. Sifat fizikal alkenes. Diambil dari: Pembekuan Kimia.com
- Wikipedia. (2018). Alkene. Diambil dari: dalam.Wikipedia.org
- Kimia Librettexts. Sifat fizikal alkenes. Diambil dari: chem.Libretxts.org
- Whitten, Davis, Peck & Stanley. Kimia. (8th ed.). Pembelajaran Cengage.
- Francis a. Tortoiseshell. Kimia organik. (Edisi Keenam., Halaman 194). MC Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkenes: formula molekul dan struktur. Diambil dari: cliffsnotes.com
- Chipera, Angie. (25 April 2017). Apa itu olefin dalam kimia? Saintifik. Diambil dari: saintifik.com

