Kalsium bikarbonat

- 4344
- 388
- Ms. Edgar Carroll
 Kalsium bikarbonat adalah garam tak organik kumpulan bikarbonat
Kalsium bikarbonat adalah garam tak organik kumpulan bikarbonat Apa itu kalsium bikarbonat?
Dia Kalsium bikarbonat Ia adalah garam bukan organik dengan formula kimia CA (HCO3)2. Ia berasal dari alam dari kalsium karbonat yang terdapat di batu kapur dan batu mineral seperti kalsit.
Kalsium bikarbonat lebih larut dalam air daripada kalsium karbonat. Ciri ini telah membolehkan pembentukan sistem karst di batu batu kapur dan dalam penstrukturan gua.
Air bawah tanah yang melintasi retak adalah tepu dalam anjakan karbon dioksida mereka (CO2).
Air ini menghancurkan batu kapur yang melepaskan kalsium karbonat (Caco3) bahawa kalsium bikarbonat akan terbentuk, menurut reaksi berikut:
Pencuri3(s) +co2(g) +h2Atau (l) => ca (HCO3)2(aq)
Tindak balas ini berlaku di gua -gua di mana air yang sangat keras berasal. Kalsium bikarbonat tidak berada dalam keadaan pepejal tetapi dalam larutan akueus, bersama -sama dengan CA2+, Bicarbonate (HCO3-) dan ion karbonat (CO32-).
Selepas itu, dengan mengurangkan ketepuan karbon dioksida di dalam air, tindak balas terbalik berlaku, iaitu transformasi kalsium bikarbonat ke kalsium karbonat:
CA (HCO3)2(aq) => co2 (g) +h2Atau (l) +caco3 (S)
Kalsium karbonat sedikit larut di dalam air, ini menyebabkan hujannya berlaku sebagai pepejal. Reaksi sebelumnya sangat penting dalam pembentukan stalaktit, stalagmit dan ketebalan lain di gua.
Struktur berbatu ini terbentuk dari titisan air yang jatuh dari siling gua. Caco3 Hadir dalam titisan air dikristalisasi untuk membentuk struktur yang disebutkan di atas.
Fakta tidak menemui kalsium bikarbonat dalam keadaan pepejal telah menghalang penggunaannya, mencari beberapa contoh dalam hal ini.
Struktur kalsium bikarbonat
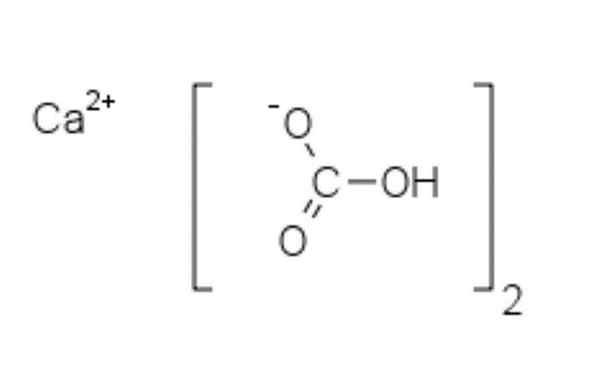 Struktur kimia kalsium bikarbonat
Struktur kimia kalsium bikarbonat Di bahagian atas dua anion HCO ditunjukkan3- dan kation2+ berinteraksi secara elektrostatik. Ca2+, Menurut imej, ia harus terletak di tengah, kerana begitu HCO3- Mereka tidak akan menangkis satu sama lain untuk caj negatif mereka.
Beban negatif dalam HCO3- Ia berpindah antara dua atom oksigen, dengan resonans antara kumpulan karbonil c = o dan pautan c-o-; Semasa di co32-, Ini dipindahkan antara tiga atom oksigen, kerana pengikatan C-O tidak dilindungi dan boleh menerima beban resonans negatif.
Ia dapat melayani anda: diphenylamineGeometri ion -ion ini boleh dianggap sebagai sfera kalsium yang dikelilingi oleh segitiga karbonat rata dengan hujung terhidrogenasi. Dari segi nisbah saiz, kalsium adalah lebih kecil daripada ion HCO3-.
Penyelesaian berair
Kalsium bikarbonat Anda tidak boleh membentuk pepejal kristal, dan ia benar -benar terdiri daripada penyelesaian berair garam ini. Di dalamnya, ion tidak bersendirian, seperti dalam imej, tetapi dikelilingi oleh molekul H2Sama ada.
Setiap ion dikelilingi oleh sfera penghidratan, yang bergantung kepada logam, polaritas dan struktur spesies terlarut.
Ca2+ Ia menyelaraskan dengan atom oksigen air untuk membentuk aquocomplex, CA (OH2)n2+, di mana n biasanya dianggap sebagai enam; iaitu, "octahedron berair" di sekitar kalsium.
Sementara anion HCO3- Mereka berinteraksi dengan baik, sama ada dengan jambatan hidrogen (atau2Co-H-oh2) atau dengan atom hidrogen air ke arah beban negatif (hoco2- H-oh, interaksi dipole).
Interaksi ini antara CA2+, HCO3- Dan air sangat cekap, sehingga mereka membuat kalsium bikarbonat sangat larut dalam pelarut itu; Tidak seperti kalsium karbonat (Caco3), di mana tarikan elektrostatik antara CA2+ dan co32- Mereka sangat kuat, mendahului penyelesaian berair.
Di samping air, terdapat co -molecules2 sekitar, yang bertindak perlahan untuk menyumbang lebih banyak HCO3- (Bergantung pada nilai pH).
Pepejal hipotetikal
Setakat ini, saiz ion dan beban dalam kalsium bikarbonat, atau kehadiran air, jelaskan mengapa tidak ada sebatian pepejal; iaitu, kristal tulen yang boleh dicirikan oleh crystallography x -ray. Kalsium bikarbonat tidak lebih daripada ion yang terdapat di dalam air dari mana pembentukan gua terus berkembang.
Ya ca2+ dan HCO3- Mereka boleh mengasingkan diri dari air yang mengelakkan tindak balas kimia berikut:
CA (HCO3)2(aq) → Caco3(s) + co2(g) + h2Atau (l)
Kemudian ini boleh dikelompokkan menjadi pepejal kristal putih dengan perkadaran stoikiometrik 2: 1 (2HCO3/1ca).
Boleh melayani anda: 30 contoh penggantungan kimiaTidak ada kajian mengenai strukturnya, tetapi dapat dibandingkan dengan natrium bikarbonat (seperti magnesium bikarbonat, mg (HCO3)2, ia juga tidak wujud sebagai pepejal), atau dengan kalsium karbonat.
Kestabilan: Natrium Bikarbonat (NAHCO3) Vs. kalsium bikarbonat (CA (HCO3)2)
Natrium bikarbonat mengkristal dalam sistem monoklinik, dan kalsium bikarbonat dalam trigonal (calcite) dan sistem ortorrombik (aragonite).
Sekiranya NA diganti+ untuk ca2+, Rangkaian kristal akan tidak stabil oleh perbezaan yang lebih besar dalam saiz; iaitu, na+ Kerana menjadi lebih kecil, ia membentuk kaca yang lebih stabil dengan HCO3- Berbanding dengan CA2+.
Malah, CA (HCO3)2(aq) memerlukan air untuk menguap supaya ionnya dapat dikelompokkan ke dalam kaca; Tetapi rangkaian kristal ini tidak cukup kuat untuk melakukannya pada suhu bilik. Apabila memanaskan air, tindak balas penguraian berlaku (persamaan dari atas).
Menjadi ion na+ Dalam penyelesaian, ini akan membentuk kaca dengan HCO3- sebelum penguraian terma.
Sebabnya mengapa kalsium bikarbonat tidak mengkristal (secara teoritis), adalah kerana perbezaan radio ionik atau saiz ion mereka, yang tidak dapat membentuk kristal yang stabil sebelum penguraiannya.
Kalsium bikarbonat (CA (HCO3)2) Vs. kalsium karbonat (Caco3)
Sekiranya sebaliknya, H ditambah+ Ke struktur kristal kalsium karbonat, mereka akan mengubah sifat fizikal secara drastik. Mungkin, titik lebur mereka jatuh dengan ketara, dan bahkan morfologi akhir kristal diubah suai.
Sifat fizikal dan kimia
Formula kimia
CA (HCO3)2
Berat molekul
162.11 g/mol
Keadaan fizikal
Ia tidak muncul dalam keadaan pepejal. Ia dijumpai dalam larutan akueus, dan apabila haba digunakan untuk menguap, ia menjadi kalsium karbonat.
Kelarutan air
16.1 g/100 ml pada 0º C; 16.6 g/100 ml pada 20º C dan 18.4 g/100 ml pada 100º C.
Nilai -nilai ini menunjukkan pertalian besar molekul air oleh ion kalsium bikarbonat, seperti yang dijelaskan dalam bahagian sebelumnya. Sementara itu, hanya 15 mg kalsium karbonat larut dalam satu liter air, yang mencerminkan interaksi elektrostatik yang kuat.
Kerana kalsium bikarbonat tidak dapat membentuk pepejal, keterlarutannya tidak dapat ditentukan secara eksperimen.
Walau bagaimanapun, memandangkan syarat -syarat yang dibuat oleh CO2 dibubarkan di dalam air yang mengelilingi batu kapur, jisim kalsium yang dibubarkan pada suhu T boleh dikira; jisim yang sama dengan kepekatan kalsium bikarbonat.
Boleh melayani anda: asid benzyik: sintesis, transposisi dan kegunaanPada suhu yang berbeza, jisim larut meningkat seperti yang ditunjukkan dalam nilai pada 0, 20 dan 100º C. Kemudian, mengikut eksperimen ini, ia ditentukan berapa banyak kalsium bikarbonat Ia larut di sekitar kalsium karbonat, dalam medium berair dengan co2.
Setelah CO melarikan diri2 Gas, kalsium karbonat akan mendakan, tetapi tidak kalsium bikarbonat.
Titik gabungan dan mendidih
Rangkaian kristal CA (HCO3)2 Ia jauh lebih lemah daripada caco3. Sekiranya ia boleh diperolehi dalam keadaan pepejal, dan mengukur suhu di mana ia cair dalam sumber, pastinya nilai akan diperolehi jauh di bawah 899º c. Begitu juga, yang sama harus dijangkakan dalam menentukan titik mendidih.
Titik pembakaran
Ia bukan bahan api.
Risiko
Oleh kerana sebatian ini tidak wujud dengan kukuh, tidak mungkin ia mewakili risiko untuk memanipulasi penyelesaian berairnya, kerana kedua -dua ion ca2+ Seperti HCO3- Mereka tidak berbahaya kepada kepekatan yang rendah; Dan oleh itu, risiko terbesar, yang akan menelan penyelesaian sedemikian, hanya boleh disebabkan oleh dos yang berbahaya kalsium yang ditelan.
Sekiranya kompaun membentuk pepejal, bahkan mungkin berbeza secara fizikal dari Caco3, Kesan toksiknya tidak dapat melampaui ketidakselesaan dan reseksi yang mudah selepas hubungan fizikal atau penyedutan.
Aplikasi
- Penyelesaian Bikarbonat Kalsium telah digunakan untuk masa yang lama untuk mencuci kertas kuno, terutamanya karya seni atau dokumen penting sejarah.
- Penyelesaian bikarbonat telah digunakan dalam pencegahan osteoporosis. Walau bagaimanapun, dalam satu kes, kesan sampingan seperti hiperkalkemia, alkalosis metabolik dan kegagalan buah pinggang telah diperhatikan dalam satu kes.
- Kalsium bikarbonat diberikan, kadang -kadang, secara intravena untuk membetulkan kesan kemurungan hipokalemia pada fungsi jantung.
- Ia digunakan untuk menenangkan keasidan perut.
Rujukan
- Wikipedia (2018). Kalsium bikarbonat. Diambil dari: dalam.Wikipedia.org
- Sirah Dubois (3 Oktober 2017). Apa itu kalsium bikarbonat? Pulih dari: livestrong.com
- Hub Pembelajaran Sains (2018). Kimia Karbonat. Pulih dari: Scientelarn.org.NZ
- PubChem (2018). Kalsium bikarbonat. Pulih dari: pubchem.NCBI.NLM.NIH.Gov

