Sejarah Boro, sifat, struktur, kegunaan

- 1072
- 7
- Anthony Breitenberg
Dia boron Ia adalah elemen bukan logam yang mengetuai kumpulan 13 dari jadual berkala dan diwakili dengan simbol kimia b. Nombor atomnya adalah 5, dan merupakan satu -satunya elemen bukan logam dalam kumpulannya; Walaupun beberapa bahan kimia menganggapnya sebagai metalloid.
Ia dibentangkan sebagai serbuk coklat hitam, dan berada dalam perkadaran 10 ppm berhubung dengan kerak bumi. Oleh itu ia bukan salah satu elemen yang paling banyak.
 Sampel boro dengan kesucian sekitar 99%. Sumber: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Sampel boro dengan kesucian sekitar 99%. Sumber: Alajhasha [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Ia adalah sebahagian daripada beberapa mineral seperti borax atau natrium borate, ini menjadi mineral boron yang paling biasa. Terdapat juga Kurnite, satu lagi bentuk natrium borerate; Colemanite atau kalsium borate; dan borato, natrium dan kalsium borato.
Boratos diekstrak di Amerika Syarikat, Tibet, China dan Chile dengan pengeluaran dunia kira -kira dua juta tan setahun.
Unsur ini mempunyai tiga belas isotop, yang paling banyak sebelasB, yang merupakan 80.1% boron, dan 10B, yang membentuk baki 19.9%.
Boron adalah jejak penting untuk tumbuh -tumbuhan, campur tangan dalam sintesis beberapa protein tumbuhan penting dan menyumbang kepada penyerapan air. Dalam mamalia nampaknya perlu untuk kesihatan tulang.
Walaupun boron itu ditemui pada tahun 1808 oleh ahli kimia Inggeris Sir Humphry Davy, dan ahli kimia Perancis Jacques Thérnard dan Joseph Gay-Lussac, sejak permulaan era kami di China digunakan Borax dalam penjelasan tembikar enamel.
Boron dan sebatiannya mempunyai banyak kegunaan dan aplikasi, mulai dari penggunaannya dalam pemuliharaan makanan, terutama marjerin dan ikan, sehingga penggunaan dalam rawatan tumor kanser otak, pundi kencing, prostat dan organ lain dan organ lain dan organ lain.
Boron tidak terlalu larut dalam air, tetapi sebatiannya. Ini boleh menjadi mekanisme tumpuan boron, serta sumber keracunan dengan elemen.
[TOC]
Sejarah
Latar belakang
Sejak Times Jauh lelaki telah menggunakan sebatian boron dalam pelbagai aktiviti. El Borax, mineral yang dikenali sebagai Tincal, digunakan di China pada tahun 300 d tahun.C. dalam penjelasan seramik enamel.
Alchemist Parsi (865-925) membuat sebutan pertama mengenai sebatian boro. Rhazes mengklasifikasikan mineral dalam enam kelas, salah satunya adalah borocies yang termasuk boron.
Agricola, sekitar 1600, melaporkan penggunaan borax sebagai aliran dalam metalurgi. Pada tahun 1777, kehadiran asid borik dalam arus mata air panas berhampiran Florence diiktiraf.
Penemuan elemen
Humphry Davy, melalui elektrolisis penyelesaian boraks, mengamati pengumpulan endapan hitam di salah satu elektrod. Dia juga menghangatkan boron oksida (b2Sama ada3) Dengan kalium, menghasilkan serbuk coklat hitam yang merupakan bentuk boron yang diketahui.
Gay-lussac dan thénard mengurangkan asid borik pada suhu tinggi dengan kehadiran besi untuk menghasilkan boron. Mereka juga menunjukkan proses terbalik, iaitu, di mana asid borik adalah produk pengoksidaan boron.
Pengenalpastian dan pengasingan
Jöns Jakob Berzelius (1827) mencapai pengenalan Boro sebagai elemen baru. Pada tahun 1892, ahli kimia Perancis Henri Moissan berjaya menghasilkan boron dengan kesucian 98%. Walaupun, ditunjukkan bahawa boron dihasilkan semata -mata oleh ahli kimia Amerika Ezekiel Weintraub, pada tahun 1909.
Sifat
Penerangan fizikal
Serbuk amorf pepejal atau hitam coklat kristal.
Boleh melayani anda: peroksida: sifat, nomenclature, kegunaan, contohJisim molar
10,821 g/mol.
Takat lebur
2076 ºC.
Takat didih
3927 ºC.
Ketumpatan
-Cecair: 2.08 g/cm3.
-Kristal dan amorf pada 20 ºC: 2.34 g/cm3.
Haba Fusion
50.2 kJ/mol.
Haba pengewapan
508 kJ/mol.
Kapasiti kalori molar
sebelas.087 j/(mol · k)
Tenaga pengionan
-Tahap Pertama: 800.6 kJ/mol.
-Tahap Kedua: 2.427 kJ/mol.
-Tahap Ketiga: 3.659.7 kJ/mol.
Elektronegativiti
2.04 pada skala Pauling.
Radio atom
90 malam (empirikal).
Jumlah atom
4.16 cm3/mol.
Kekonduksian terma
27.4 w/m.K
Resistiviti elektrik
~ 106 Ω.M (pada 20ºC).
Boron Suhu Tinggi adalah konduktor elektrik yang baik, tetapi pada suhu ambien ia menjadi hampir penebat.
Kekerasan
~ 9.5 pada skala Mohs.
Reaktiviti
Boron tidak terjejas oleh asid hidroklorik pada suhu mendidih. Walau bagaimanapun, ia ditukar oleh asid nitrik panas kepada asid borik (h3Bo3). Boro secara kimia berkelakuan seperti bukan metal.
Bertindak balas dengan semua halogen untuk memberikan trihaluros, sangat reaktif. Ini mempunyai formula umum bx3, Di mana x mewakili halogen.
Ia digabungkan dengan beberapa elemen untuk berasal dari boruros. Sebahagian daripada mereka adalah antara bahan kekerasan yang lebih besar; Sebagai contoh, Boron Nitride (BN). Boron digabungkan dengan oksigen untuk membentuk boron trioksida.
Struktur boron elektronik dan konfigurasi
Pautan dan unit struktur di boron
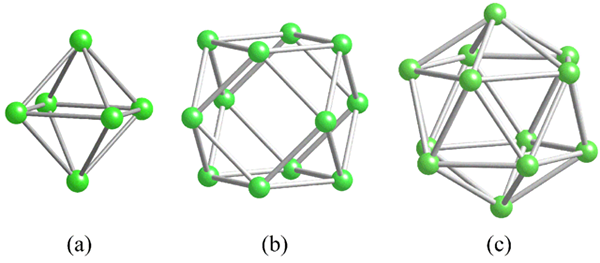 Geometri unit struktur biasa untuk boron. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Geometri unit struktur biasa untuk boron. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Sebelum menangani struktur boron (kristal atau amorf), penting untuk diingat bagaimana atom mereka dapat dihubungkan. Pautan B-B berada dalam intipati kovalen; Bukan itu sahaja, tetapi kerana atom boro secara semula jadi mempunyai kekurangan elektronik, mereka akan cuba membekalkannya dalam pautan mereka dalam satu cara atau yang lain.
Di boron terdapat jenis ikatan kovalen khas: tiga pusat dan dua elektron, 3C2E. Di sini tiga atom boron berkongsi dua elektron, dan menentukan segitiga, salah satu daripada banyak wajah yang terdapat dalam polyhedros struktur mereka (imej unggul).
Dari kiri ke kanan kita ada: Octaedro (A, B6), CuboCtaedro (B, B, B12), Dan isocasedro (c, b12 Juga). Semua unit ini berkongsi ciri: mereka miskin dalam elektron. Oleh itu, mereka perlu menghubungkan kovalen di antara mereka; Dan hasilnya adalah pesta pautan yang mengejutkan.
Di setiap segitiga polyhedros ini, pautan 3C2E hadir. Jika tidak, ia tidak dapat dijelaskan bagaimana boron, yang mampu membentuk hanya tiga ikatan kovalen mengikut teori pautan Valencia, boleh mempunyai sehingga lima pautan dalam unit polyhedral ini.
Struktur boron kemudian terdiri daripada susunan dan pengulangan unit -unit ini yang akhirnya menentukan kristal (atau pepejal amorf).
Boro α-Romboédrico
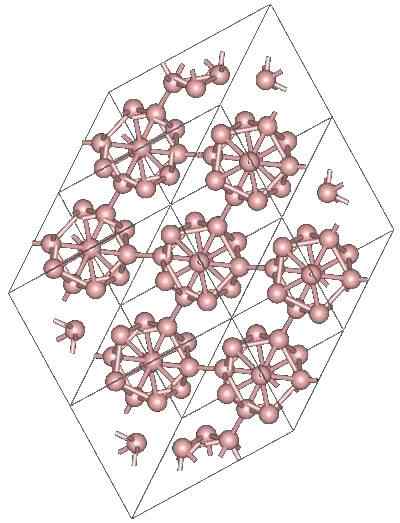 Struktur kristal α-romboédrico boron alotropic. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur kristal α-romboédrico boron alotropic. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Mungkin terdapat unit polyhedral lain Boro, serta sebatian hanya dengan dua atom, b2; "garis" boron yang mesti dikaitkan dengan atom lain berikutan kekurangan elektronik yang tinggi.
Icosaedro adalah perpaduan boron yang disukai; Yang terasa lebih baik. Dalam imej atas, sebagai contoh, dihargai bagaimana unit b ini12 Mereka menjalin hubungan dengan menentukan kristal rhombohedral boron-α.
Sekiranya salah satu daripada icosaedros itu mahu diasingkan, ia akan menjadi tugas yang rumit, kerana kekurangan elektronik mereka memaksa mereka untuk menentukan kristal di mana setiap orang menyediakan elektron yang diperlukan oleh jiran -jiran lain.
Β-romboédrico boron
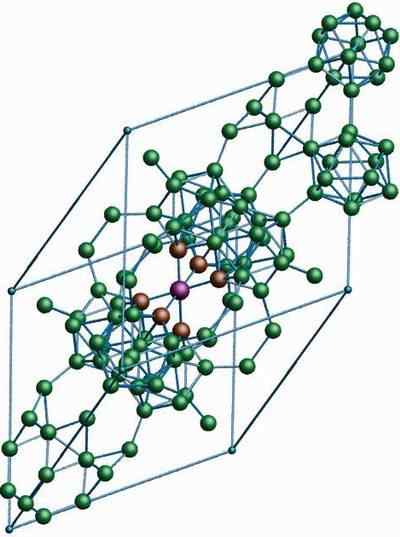 Struktur kristal β-romboédrico boron alotropic. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur kristal β-romboédrico boron alotropic. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Β-romboédrico boron alotropic, seperti namanya sudah menunjukkan, mempunyai kristal rhomboédica serta boron-α; Walau bagaimanapun, ia berbeza dalam unit strukturnya. Ia kelihatan seperti kapal luar angkasa yang dibuat dengan atom boron.
Ia boleh melayani anda: lithium hidroksida (lioh)Sekiranya anda dapat melihat unit icosahedric dengan teliti dengan cara yang bijak dan digabungkan (di tengah). Terdapat juga unit B10 dan atom boron kesepian yang bertindak sebagai jambatan untuk unit yang disebutkan di atas. Dari semua, ini adalah alotrope boron yang paling stabil.
BORO-γ GEMA
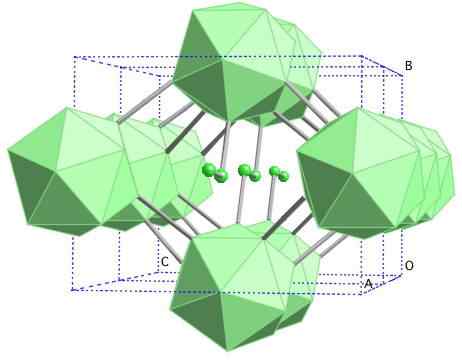 Struktur kristal boron-γ. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur kristal boron-γ. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Dalam alotrope boron ini, unit b diselaraskan2 dan b12. B2 membentangkan banyak kekurangan elektronik yang sebenarnya mengeluarkan elektron dari b12 Oleh itu, ada watak ionik dalam pepejal ini. Iaitu, bukan sahaja mereka bersatu kovalen, tetapi ada jenis tarikan elektrostatik [b2-] [B12+].
Boro-γ mengkristal dalam struktur garam gema, sama seperti untuk NaCl. Alotrop lain dari boron ke tekanan tinggi (20 GPa) dan suhu (1800 ° C) diperolehi, dan kemudian tetap stabil dalam keadaan normal. Kestabilan faktualnya bersaing dengan β-romboédrico boron.
Kubik dan amorf
Alotropes lain boron terdiri daripada agregat atom B seolah -olah mereka bersatu dengan ikatan logam, atau seolah -olah mereka adalah kristal ionik; iaitu, ia adalah boron padu.
Juga, dan sekurang -kurangnya, adalah boron amorf, yang pelupusan unit b12 Ia rawak dan kemas. Ia dibentangkan sebagai serbuk warna gelap dan kaca berwarna terang dan kaca.
Borofenos
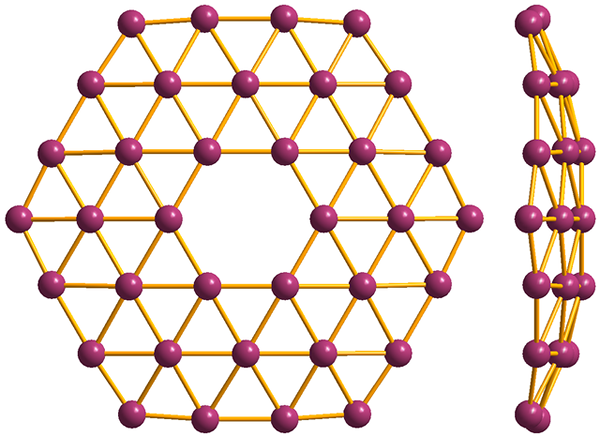 Struktur yang paling mudah dari Borofenos, B36. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Struktur yang paling mudah dari Borofenos, B36. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Dan akhirnya adalah Alotropik Boro: Borofenos (Imej Tinggi) yang paling novel dan pelik). Ia terdiri daripada lapisan monyet atom boron; sangat nipis dan sama dengan graphene. Perhatikan bahawa ia mengekalkan segitiga yang terkenal, ciri kekurangan elektronik bahawa atomnya menderita.
Sebagai tambahan kepada borofenos, di mana b36 Ia adalah yang paling mudah dan kecil, ada juga kelompok Boro. Borosferene (imej di bawah) terdiri daripada sangkar sfera yang serupa dengan bola empat puluh atom boro, b40; Tetapi bukannya mempunyai tepi yang lancar, mereka tiba -tiba dan tidak teratur:
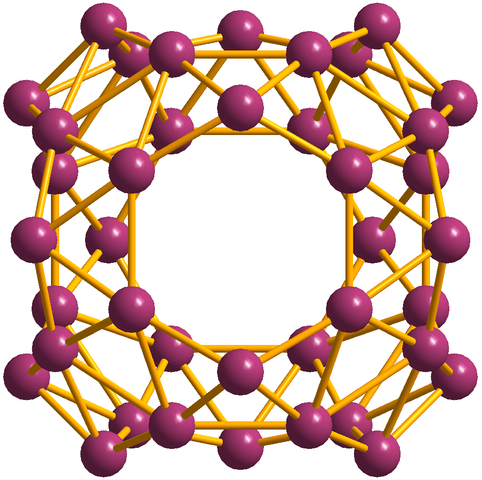 Unit Borosferenos, B40. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Unit Borosferenos, B40. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Konfigurasi Elektronik
Konfigurasi elektronik boron adalah:
[Dia] 2s2 2 p1
Oleh itu, tiga elektron dari Valencia. Dia tidak mempunyai lima lagi untuk melengkapkan oktetanya dari Valencia, dan dia hampir tidak dapat membentuk tiga ikatan kovalen; Saya memerlukan pautan dative keempat untuk menyelesaikan oktet anda. Boron boleh kehilangan tiga elektron untuk memperoleh keadaan pengoksidaan +3.
Memperoleh
Boron diasingkan dengan mengurangkan asid borik dengan magnesium atau aluminium; Kaedah yang serupa dengan gay-lussac dan thénard. Ia mempunyai kesukaran pencemaran boron dengan boruros logam tersebut.
Sampel kesucian yang tinggi boleh diperolehi dengan pengurangan gas trichloride boron, atau tribromida, dengan hidrogen pada filamen elektrik yang dipanaskan secara elektrik.
Boron kesucian yang tinggi disediakan oleh penguraian pada suhu diborano tinggi, diikuti dengan pemurnian oleh gabungan zon atau czocharalski proses.
Aplikasi
Dalam industri
Elemental Boron telah digunakan dalam pengerasan keluli. Dalam aloi dengan besi yang mengandungi boron antara 0.001 dan 0.005 %. Ia juga digunakan dalam industri yang tidak ferum, biasanya sebagai deoksida.
Di samping itu, boron digunakan sebagai berlumpur dalam aloi berasaskan tembaga dan tembaga konduktansi yang tinggi. Dalam industri semikonduktor, sejumlah kecil boro ditambah sebagai ejen doping silikon dan germanio.
Boleh melayani anda: isopreno: struktur, sifat, aplikasiBoro Oxide (B2Sama ada3) dicampur dengan silika untuk membuat kaca tahan panas (kaca borosylicate), digunakan dalam peralatan dapur dan peralatan makmal tertentu.
Boro Carbide (B4C) Ia adalah bahan yang sangat sukar yang digunakan sebagai agen kasar dan tetulang dalam bahan komposit. Aluminium Boruro (Alb12) Ia digunakan sebagai pengganti habuk berlian untuk frosted dan digilap.
Boro digunakan dalam aloi, contohnya dalam magnet nadir bumi, mengutuk dengan besi dan neodymium. Magnet yang terbentuk digunakan dalam pembuatan mikrofon, suis magnet, fon kepala dan pemecut zarah.
Dalam bidang perubatan
Kapasiti isotop Boro-10 (10B) Untuk menangkap neutron, memancarkan sinaran α -jenis telah digunakan untuk rawatan tumor otak dalam teknik yang dikenali sebagai terapi penangkapan neutron boron (BNCT).
Dia 10B dalam bentuk sebatian terkumpul dalam tumor kanser. Selanjutnya, zon tumor dengan neutron dipancarkan. Ini berinteraksi dengan 10B, apa yang menyebabkan pelepasan zarah α. Zarah -zarah ini mempunyai kesan biologi relatif yang tinggi dan disebabkan saiznya yang besar, mereka mempunyai sedikit jangkauan.
Oleh itu, tindakan yang merosakkan zarah α dikurung dalam sel -sel tumor, melakukan kemusnahan mereka. BNCT juga digunakan dalam rawatan leher, hati, pundi kencing dan tumor prostat.
Tindakan biologi
Sebilangan kecil asid borik atau boron berbentuk benteng diperlukan untuk pertumbuhan banyak tumbuhan. Kekurangan boron ditunjukkan dalam pertumbuhan tumbuhan yang cacat; "hati coklat" sayur -sayuran; dan "reput kering" bit gula.
Boron mungkin diperlukan dalam kuantiti yang kecil untuk mengekalkan kesihatan tulang. Terdapat kajian yang menunjukkan bahawa kekurangan boron akan terlibat dalam generasi arthritis. Ia juga akan campur tangan dalam fungsi otak seperti memori dan koordinasi mata lelaki.
Sebilangan pakar menunjukkan bahawa 1.5 hingga 3 mg boron harus dimasukkan dalam diet harian.
Risiko dan berhati -hati
Boron, boron oksida, asid borik dan boratos, dianggap tidak -toksik. LD50 untuk haiwan adalah 6 g boron/kg berat badan, manakala bahan dengan LD50 lebih besar daripada 2 g/kg berat badan dianggap tidak -toksik.
Sebaliknya, penggunaan lebih daripada 0.5 mg/boron hari selama 50 hari menyebabkan masalah pencernaan kecil, mencadangkan ketoksikan. Beberapa laporan menunjukkan bahawa pengambilan boron yang berlebihan dapat mempengaruhi fungsi perut, hati, buah pinggang dan otak.
Begitu juga, kesan menjengkelkan pendek telah ditunjukkan dalam nasofaring, saluran pernafasan atas dan mata untuk pendedahan kepada boron.
Laporan mengenai ketoksikan boron adalah terhad dan dalam banyak kes, ketoksikan dibentangkan pada dos yang sangat tinggi, lebih tinggi daripada penduduk umum terdedah.
Cadangannya adalah untuk memantau kandungan makanan boron, terutamanya sayur -sayuran dan buah -buahan. Agensi kesihatan kerajaan mesti memantau bahawa kepekatan boron air tidak melebihi had yang dibenarkan.
Pekerja yang terdedah kepada habuk yang mengandungi boron harus memakai topeng yang melindungi saluran pernafasan, sarung tangan dan kasut khas.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Allotropes boron. Diperoleh dari: dalam.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Kuliah 5b. Struktur unsur-unsur (bukan logam, b, c). Jabatan Kimia, Universiti Hindia Barat, Kampus Mona, Kingston 7, Jamaica. Pulih dari: chem.Uwimona.Edu.JM
- Manisha Lalloo. (28 Januari 2009). Struktur boron ultra-lure ditemui. Dunia kimia. Pulih dari: dunia kimia.com
- Bell Terence. (16 Disember 2018). Profil boron logam. Pulih dari: theBalance.com
- Editor enyclopaedia Britannica. (2019). Boron. Pulih dari: Britannica.com
- Agensi untuk bahan toksik dan pendaftaran penyakit. (2010). Toxfaqs ™ di Boron. [Pdf]. Diperolehi dari: ATSDR.CDC.Gov
- Helmestine, Anne Marie, Ph.D. (6 Februari 2019). Sifat bahan kimia & fizikal boron. Pulih dari: Thoughtco.com

