Haba pembakaran

- 3055
- 290
- Horace Gulgowski
Apakah haba pembakaran?
Dia Haba pembakaran Ia adalah tenaga yang dikeluarkan apabila sejumlah bahan, biasanya satu mol, bertindak balas secara eksotermik dengan oksigen udara. Ia adalah harta termokimia penting dalam pencirian bahan api, alkohol dan, terutamanya, hidrokarbon, seperti butana dan metana.
Apabila bahan membakar cahaya dan panas, tenaga yang boleh digunakan untuk berfungsi pada badan lain. Sebagai contoh, haba yang dihasilkan mampu memanaskan jumlah air yang besar, yang stim menekan persekitaran, bertindak beberapa penjana elektrik; atau semata -mata, pemanasan lebih lanjut makanan kukus.
 Haba yang dihasilkan oleh pembakaran gas dapur digunakan untuk memanaskan kaul dan makanan
Haba yang dihasilkan oleh pembakaran gas dapur digunakan untuk memanaskan kaul dan makanan Haba pembakaran berbeza antara semua bahan, walaupun sifat kimianya pada dasarnya sama. Variasi ini sepadan dengan kestabilan relatif, iaitu: sebatian yang lebih tidak stabil, semakin besar tenaga yang dikeluarkan, diwakili sebagai -ΔH. Simbol negatif bermaksud bahawa haba mengalir keluar.
Nilai -nilai yang berbeza digunakan untuk membandingkan kestabilan relatif antara alkaus yang berbeza dan isomer mereka. Ia juga membolehkan ia stabil.
Pengukuran
Untuk mengukur pemanasan pembakaran, pam kalorimetrik diperlukan. Di dalamnya bahan bertindak balas dengan oksigen dengan pengaktifan percikan elektrik.
Kemudian, haba yang dilepaskan memanaskan jumlah air yang mengelilingi petak sampel, mengukur suhu sebelum dan selepas pembakaran, serta jisim air dan bahan bakar.
Jadi, tenaga yang dikeluarkan akan sama dengan:
Ceh2o·mH2Atau · Δt
Di manaeh2o Ia adalah haba air tertentu, 4.184 j/g · ºC, mH2Atau jisim air, dan ΔT perubahan suhunya. Akhirnya, haba ini, yang dinyatakan dalam unit joule atau kalori, dibahagikan antara jisim atau tahi lalat bahan api yang diletakkan di dalam pam kalorimetrik, untuk mendapatkan haba pembakaran per unit jisim atau tahi lalat.
Boleh melayani anda: Apakah setara mekanikal panas?Logam tidak menggabungkan diri mereka, tetapi mengoksidakan pada kelajuan yang berbeza bergantung pada suhu di mana mereka terdedah. Haba yang mereka hasilkan boleh diukur dengan cara yang sama seperti yang dilakukan dengan hidrokarbon dan bahan api lain. Oleh itu, mereka tidak dapat dibakar.
Tenaga berpotensi
Semasa pembakaran pautan dipecahkan untuk membentuk yang baru, lebih stabil. Tenaga yang terkandung dalam semua pautan molekul adalah bebas daripada pergerakannya, jadi ada tenaga yang berpotensi.
Semakin besar tenaga yang berpotensi, semakin tidak stabil molekul akan dan, oleh itu, ia akan melepaskan lebih banyak haba setelah pautan baru ditubuhkan.
Untuk mengetahui yang betul -betul pautan baru ini, produk pembakaran lengkap harus dipertimbangkan: co2 Untuk karbon, h2Atau untuk hidrogen, dan tidak2 Untuk nitrogen. Berkenaan dengan hidrokarbon, pembakaran lengkap mereka akan menghasilkan campuran stoikiometrik Co2 dan h2Sama ada.
Kedua -dua molekul, co2 dan h2Atau, mereka mempunyai tenaga berpotensi yang sangat rendah, kerana pautan mereka (O = C = O dan H-O-H) sangat stabil berbanding dengan pautan hidrokarbon dari mana mereka datang (C-H dan C-C).
Kestabilan relatif
Tenaga berpotensi bebas. Tetapi variasi mereka tidak, iaitu perbezaan tenaga antara produk (CO2 dan h2O) dan reaktan (hidrokarbon).
Itulah sebabnya mempunyai variasi ini, atau apa yang sama, pembakaran mereka memanaskan, anda boleh tahu apakah kestabilan relatif antara satu set hidrokarbon atau isomer.
Tutup
Alkanes boleh linear, bercabang atau kitaran. Dalam kes alkana linear, haba pembakarannya berbeza -beza bergantung kepada panjang rantai; iaitu, ia bergantung pada berapa banyak unit ch2 mempunyai. Pertimbangkan contoh n-Hexane, n-heptano dan n-Octane:
Ia boleh melayani anda: iodin: sejarah, sifat, struktur, mendapatkan, risiko, kegunaanCh3(Ch2)4Ch3, -ΔH = 4163 kJ/mol
Ch3(Ch2)5Ch3, -ΔH = 4817 kJ/mol
Ch3(Ch2)6Ch3, -ΔH = 5471 kJ/mol
Anda dapat melihat bahawa pembakarannya menjadi berbeza dengan 654 kJ/mol. Ini bermaksud bahawa setiap cho2 yang ditambah ke rantai meningkatkan haba pembakaran pada kadar 654 kJ/mol. Oleh itu, nonano, ch3(Ch2)7Ch3, Ia akan mempunyai haba pembakaran sama dengan 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Ini sama dengan mengatakan bahawa rantai yang lebih lama mempunyai tenaga yang lebih besar, dan oleh itu, mereka lebih tidak stabil.
Alkanes Ramified lebih stabil daripada linear, dan ini disimpulkan dari pemanasan pembakaran mereka. Pertimbangkan sekarang kes tiga isomer oktana:
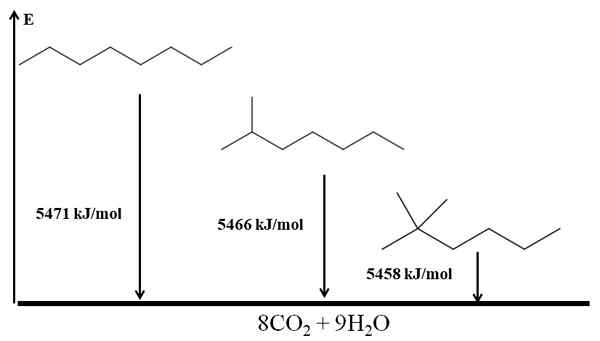 Pembakaran memanaskan untuk tiga isomer oktana. Sumber: Gabriel Bolívar melalui Molview.
Pembakaran memanaskan untuk tiga isomer oktana. Sumber: Gabriel Bolívar melalui Molview. Dia n-Octano adalah yang paling tidak stabil kerana haba pembakarannya adalah yang terbesar (5471 kJ/mol). Sebaliknya, isomer 2-methylheptano dan 2.2-dimetilhexan. 2.2-dimetilhexan adalah yang paling stabil kerana menjadi yang paling bercabang dari tiga isomer.
Alkenes
Kestabilan relatif alkena juga boleh diperolehi dari pemanasan pembakaran mereka. Pertimbangkan, sebagai contoh, empat isomer Butenus:
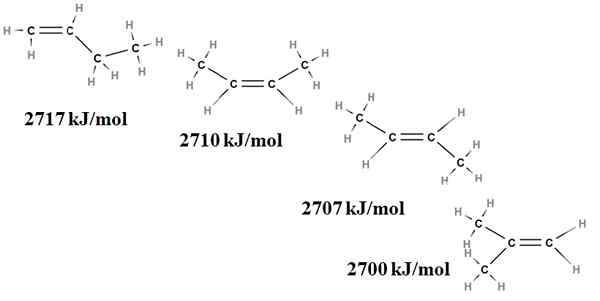 Pemanasan pembakaran untuk isomer buteno. Sumber: Gabriel Bolívar melalui Molview.
Pemanasan pembakaran untuk isomer buteno. Sumber: Gabriel Bolívar melalui Molview. Di sini kita tidak lagi bercakap tentang ramalan, tetapi mengenai tahap penggantian ikatan berganda, C = C, dan ketegangan van der Waals; iaitu, penolakan elektronik dan sterik antara dua kumpulan besar yang terletak di sisi yang sama dengan ikatan berganda.
Isomer pertama, 1-butena, adalah yang paling tidak stabil kerana ikatan gandanya kurang diganti (h2C = c). Ini ditunjukkan dalam haba pembakarannya sebanyak 2717 kJ/mol.
Boleh melayani anda: asid klorogenikDi sebelah kanan, cis-2-butena, sedikit lebih stabil kerana ikatan gandanya lebih diganti. Tetapi trans-2-butena lebih banyak lagi, kerana walaupun ia mempunyai tahap penggantian yang sama, kumpulan choons3 ikatan berganda berada dalam kedudukan trans, iaitu, di sisi yang berlainan dari ikatan berganda. Perhatikan bahawa haba trans-2-butena (2707 kJ/mol) hampir tidak lebih rendah daripada cis-2-butena (2710 kJ/mol).
Isomer terakhir, 2-methyl-2-butene, yang juga digantikan sebagai cis dan trans 2 bungeo, namun yang paling tidak stabil. Ini kerana kedua -dua ch3 Mereka ditemui di salah satu karbon ikatan berganda, oleh itu menjadi alkena dengan cho3 Permata.
Sebatian Carbonyl
Serta Alkos, dan hidrokarbon lain secara umum, kestabilan relatif sebatian karbonyl (keton, aldehid, asid karboksilat) juga berkaitan dengan pemanasan pembakaran mereka.
Oleh itu, lebih stabil, atau kurang reaktif kumpulan mereka c = o, anak -anak di bawah umur akan menjadi pemanasan pembakaran mereka.
Sebagai contoh, panas pembakaran butanal, ch3Ch2Ch2Cho, ini 2475 kJ/mol. Haba ini lebih tinggi daripada 2-Butanon, CH3Ch2COCH3, yang sama dengan 2442 kJ/mol. Oleh itu, butanal lebih tidak stabil daripada 2-butanon.
Dalam 2-butanon c = o lebih stabil terima kasih kepada kumpulan ch ch3Ch2 dan ch3; Perkara yang tidak berlaku dengan butan, di mana salah satu kumpulan hampir tidak ada atom h.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Haba pembakaran. Diperoleh dari: dalam.Wikipedia.org
- Yayasan CK-12. Haba pembakaran. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- BBC. (2020). Tenaga Kimia: Enthalpy Pembakaran. Diperolehi dari: BBC.co.UK
- Steven a. Hardinger. (2017). Glosari Glosari Kimia Organik: Entalpi Pembakaran. Pulih dari: chem.UCLA.Edu

