Haba tindak balas
- 674
- 75
- Horace Gulgowski
 Skim haba tindak balas di bawah keadaan suhu dan tekanan tertentu. Sumber: Joseasorrentino, CC By-SA 4.0, Wikimedia Commons
Skim haba tindak balas di bawah keadaan suhu dan tekanan tertentu. Sumber: Joseasorrentino, CC By-SA 4.0, Wikimedia Commons Apa itu haba reaksi?
Dia haba tindak balas, O reaksi entalpi (ΔH), adalah jumlah tenaga setiap tahi lalat yang dibebaskan atau dihasilkan dalam tindak balas kimia pada tekanan malar. Ia adalah unit termodinamik yang berguna untuk mengira tenaga yang dikeluarkan atau dihasilkan.
Oleh kerana entalpi berasal dari tekanan, jumlah dan tenaga dalaman, yang semuanya berfungsi, entalpi juga merupakan fungsi negara.
ΔH, atau perubahan entalpi, timbul sebagai satu unit ukuran yang bertujuan untuk mengira perubahan tenaga sistem apabila menjadi terlalu sukar untuk mencari ΔU, atau perubahan dalam tenaga dalaman sistem, secara serentak mengukur jumlah haba dan kerja yang ditukar.
Memberi.
Notasi ΔHº atau ΔHºr Kemudian timbul untuk menjelaskan suhu dan tekanan tepat dari haba reaksi ΔH.
Entalpi tindak balas standard dilambangkan oleh ΔHº atau ΔHºRXN dan boleh menganggap nilai positif dan negatif. Unit untuk ΔHº adalah kilojulios per mol, atau kJ / mol.
Konsep terdahulu untuk memahami haba tindak balas: perbezaan antara ΔH dan ΔHºr
- Δ = mewakili perubahan entalpi (entalpi produk kecuali entalpi reaktan).
Nilai positif menunjukkan bahawa produk mempunyai entalpi yang lebih besar, atau bahawa ia adalah tindak balas endotermik (haba diperlukan).
Nilai negatif menunjukkan bahawa reaktan mempunyai entalpi yang lebih besar, atau bahawa ia adalah tindak balas eksotermik (haba berlaku).
- º = bermaksud bahawa tindak balas adalah perubahan entalpi standard, dan berlaku pada tekanan / suhu yang telah ditetapkan sebelum ini.
- R = menunjukkan bahawa perubahan ini adalah entalpi reaksi.
Boleh melayani anda: kalsium: sifat, struktur, mendapatkan, menggunakan- Keadaan standard: keadaan standard pepejal atau cecair adalah bahan tulen pada tekanan 1 bar, atau apa yang sama, 1 atmosfera (105 pa) dan suhu 25 ° C, atau apa yang sama, 298 k.
- ΔHºr Ia adalah haba standard tindak balas atau entalpi standard tindak balas, dan sebagai ΔH juga mengukur entalpi reaksi. Walau bagaimanapun, ΔHºrxn berlaku dalam keadaan "standard", yang bermaksud bahawa tindak balas berlaku pada 25 ° C dan 1 atm.
Manfaat pengukuran ΔH di bawah keadaan standard terletak pada keupayaan untuk mengaitkan nilai ΔHº dengan yang lain, kerana ia berlaku dalam keadaan yang sama.
Haba pembentukan
Haba pembentukan standard, ΔHFº, bahan kimia adalah jumlah haba yang diserap atau dibebaskan dari pembentukan 1 mol bahan kimia itu pada 25 ° C dan 1 bar unsur -unsurnya dalam keadaan standardnya.
Elemen berada dalam keadaan standardnya jika ia berada dalam bentuk yang paling stabil dan keadaan fizikalnya (pepejal, cecair atau gas) pada 25 ° C dan 1 bar.
Sebagai contoh, haba standard pembentukan untuk karbon dioksida menyiratkan oksigen dan karbon sebagai reagen.
Oksigen lebih stabil kerana molekul gas atau2, Walaupun karbon lebih stabil sebagai grafit pepejal (grafit lebih stabil daripada berlian dalam keadaan standard).
Untuk menyatakan definisi dengan cara yang lain, haba standard pembentukan adalah jenis haba reaksi standard khas.
Reaksi adalah pembentukan 1 mol bahan kimia unsur -unsurnya dalam keadaan standardnya dalam keadaan standard.
Boleh melayani anda: watak logamHaba standard pembentukan juga dipanggil entalpi standard pembentukan (walaupun ia benar -benar perubahan dalam entalpi).
Secara definisi, pembentukan unsur itu sendiri tidak akan menghasilkan sebarang perubahan dalam entalpi, jadi haba reaksi standard untuk semua elemen adalah sifar.
Pengiraan entalpi reaksi
1. Pengiraan eksperimen
Entalpi dapat diukur secara eksperimen dengan menggunakan kalorimeter. Calorimeter adalah instrumen di mana sampel bertindak balas melalui kabel elektrik yang memberikan tenaga pengaktifan. Sampel dijumpai di dalam bekas yang dikelilingi oleh air, yang sentiasa gelisah.
Apabila mengukur dengan kalorimeter perubahan suhu yang berlaku apabila sampel bertindak balas, dan mengetahui haba tertentu air dan jisimnya, haba yang melepaskan atau menyerap tindak balas dikira oleh persamaan q = cesp x m x Δt.
Dalam persamaan ini, apa yang panas, CESP adalah haba tertentu, dalam kes air ini, yang sama dengan 1 kalori per gram, m adalah jisim air dan ΔT adalah perubahan suhu.
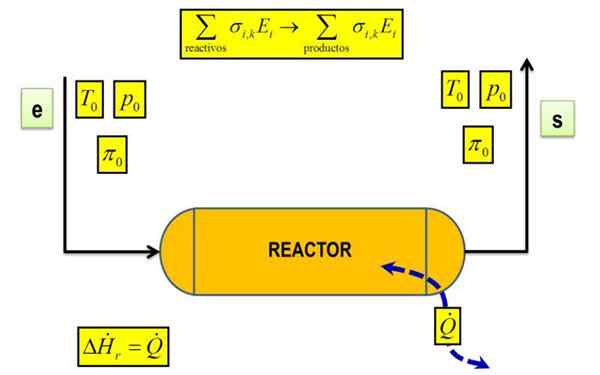
Calorimeter adalah sistem terpencil yang mempunyai tekanan malar, jadi ΔHr= Q
2. Pengiraan teoritis
Perubahan entalpi tidak bergantung pada laluan tertentu tindak balas, tetapi hanya pada tahap tenaga global produk dan reagen. Entalpía adalah fungsi negara, dan oleh itu, ia adalah bahan tambahan.
Untuk mengira entalpi standard tindak balas, kita dapat menambah enthalpi standard pembentukan reagen dan tolaknya dari jumlah enthalpies pembentukan produk standard. Secara matematik, ini memberi kita:
Ia dapat melayani anda: 6 petunjuk pH semulajadi dan ciri -ciri merekaΔHr° = σ ΔHFº (produk) - σ ΔHFº (reaktan).
Reaksi enthalpi biasanya dikira dari enthalpies pembentukan reagen dalam keadaan normal (1 tekanan bar dan suhu 25 ° C).
Untuk menerangkan prinsip termodinamik ini, kami akan mengira entalpi tindak balas untuk pembakaran metana (CH4) Mengikut formula:
Ch4 (g) + ke -22 (g) → Co₂ (g) + 2h2O (g)
Untuk mengira entalpi reaksi standard, kita perlu mencari enthalpies latihan standard bagi setiap reagen dan produk yang terlibat dalam reaksi.
Ini biasanya terdapat dalam lampiran atau dalam beberapa jadual dalam talian. Untuk tindak balas ini, data yang kita perlukan adalah:
HFCh4 (g) = -75 kjoul/mol.
HFº O2 (g) = 0 kjoul/mol.
HFº CO₂ (g) = -394 kjoul/mol.
HFº h₂o (g) = -284 kjoul/mol.
Perhatikan bahawa kerana ia berada dalam keadaan standardnya, entalpi pembentukan gas standard adalah 0 kJ / mol.
Seterusnya, kami meringkaskan enthalpies latihan standard kami. Perlu diingat bahawa kerana unit berada dalam kJ / mol, kita perlu membiak oleh koefisien stoikiometrik dalam persamaan reaksi seimbang.
Σ ΔHFº (produk) = ΔHFº CO₂ +2 ΔHFº H₂o
Σ ΔHFº (produk) = -1 (394 kjoul/mol) -2 (284 kjoul/mol) = -962 kjoul/mol
Σ ΔHFº (reaktan) = ΔHFCh4 + ΔHFº O2
Σ ΔHFº (reaktan) = -75 kjoul/mol + 2 (0 kjoul/mol) = -75 kjoul/mol
Sekarang, kita dapat mencari entalpi standard reaksi:
ΔHr° = σ ΔHFº (produk) - σ ΔHFº (reaktan) = (- 962)- (- 75) =
ΔHr° = - 887KJ / mol.
Rujukan
- Enthalpy definisi tindak balas. Pulih dari pemikiran.com.
- (S.F.). Entalpi reaksi standard. Pulih dari tak terbatas.com.

