Pembentukan karbokati, ciri, jenis, kestabilan
- 3216
- 636
- Miss Elmer Hagenes
A Carbocation, Seperti namanya, ia adalah ion organik yang mempunyai atom karbon yang dimuatkan secara positif, yang dicirikan oleh sangat tidak stabil, yang ada untuk masa yang singkat. Ia biasanya merupakan perantara dalam tindak balas organik, iaitu, ia berasal sebagai langkah -langkah yang sangat diperlukan dari mekanisme molekul masing -masing.
Secara sejarah terdapat titik konflik dalam pemampatan apa itu Carbocation. Ini kerana terdapat simfin molekul reaktif yang, atas sebab tertentu atau yang lain, memperoleh beban positif di salah satu karbon mereka. Karbokasi klasik, jadi untuk bercakap, adalah salah satu yang boleh diwakili oleh formula umum imej di bawah.
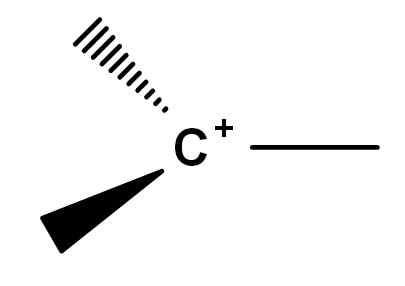 Formula umum karbohidrat. Sumber: Gabriel Bolívar.
Formula umum karbohidrat. Sumber: Gabriel Bolívar. Perhatikan bagaimana beban positif terletak tepat pada atom karbon, dan juga tidak mempunyai pautan. Oleh itu, karbohidrat adalah elektron miskin, ini menjadi punca kereaktifan yang tinggi.
Katakan Metana, Cho4. Jika karbon kehilangan salah satu atom hidrogennya, kami akan menghapuskan salah satu daripada empat ikatan C-H. Kemudian metil karbohidrat berasal, CH3+, yang kita dapat mewakili hanya dengan meletakkan atom hidrogen di hujung jalur formula atas. Ch3+ Ia adalah yang paling mudah dari semua karbokati.
[TOC]
Latihan
Bagaimana Carbocations Dibentuk? Jawapannya dijumpai dalam mekanisme reaksi. Walau bagaimanapun, bahagian majoriti yang besar dalam satu daripada dua aspek berikut:
-Pecah heterolytic
-Penambahan elektron π ke elektrofil
Pecah heterolytic
Dalam pecah heterolitik ikatan c-g, g menjadi atom atau kumpulan, ia dipecahkan dengan cara yang tidak sama rata: elektron ikatan dibiarkan g, sementara atom karbon memperoleh beban positif. Sebagai contoh:
Boleh melayani anda: arsenik: sejarah, struktur, sifat, kegunaan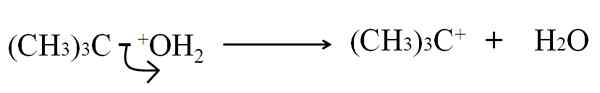 Pecah heterolitik dalam dehidrasi tertbutanol. Sumber: Gabriel Bolívar.
Pecah heterolitik dalam dehidrasi tertbutanol. Sumber: Gabriel Bolívar. Sekarang, rehat ini dapat diberikan untuk beberapa kaedah, yang seterusnya akan mengubah mekanisme dan reaksi yang dipertimbangkan.
Penambahan elektron π ke elektrofil
Proses lain yang mana karbohidrat terbentuk, yang sangat biasa dalam alkena dan sebatian aromatik, adalah dengan menyerang elektron ikatan ganda ke elektrofil. Kes -kes yang paling biasa adalah penghidrogenan alkena dengan tindakan asid:
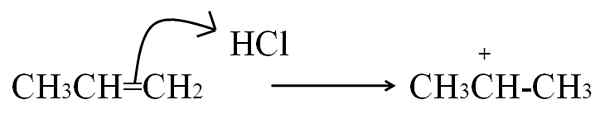 Reaksi HCl dengan propeno untuk membentuk karbohidrat sebagai perantara. Sumber: Gabriel Bolívar.
Reaksi HCl dengan propeno untuk membentuk karbohidrat sebagai perantara. Sumber: Gabriel Bolívar. Persamaan ini sepadan dengan pembentukan karbohidrat, yang ianya adalah perantara, Bukan produk. Elektron ikatan berganda menyerang HCL Hydrogen, Electrophil. Hidrogen ditambah kepada karbon di sebelah kanan ikatan berganda, jadi kumpulan -ch terbentuk3, Semasa karbon di sebelah kiri memperoleh beban positif.
Ciri -ciri
Hibridisasi
Formula umum yang dibentangkan pada mulanya mendedahkan geometri rata trigonal di sekitar atom karbon. Ini disebabkan oleh hibridisasi yang dialami oleh orbital atom karbon untuk menjadi orbital sp hibrid2, yang dipisahkan pada sudut 120º. Walaupun tidak diwakili, karbohidrat mempunyai orbital p Tulen dan kosong, mampu menerima elektron.
Keasidan
Carbocation adalah spesies berasid, sama ada mengikut definisi Brönsted atau Lewis. Elektron permintaan positif mereka atau atom hidrogen yang diberikan. Oleh sebab itu, karbokati tidak dapat dibentuk dalam media yang sangat asas, kerana mereka akan segera bertindak balas terhadap produk lain.
Kestabilan
Hibridisasi sp2 karbohidrat menjadikannya terdedah kepada serangan spesies kaya dalam elektron. Ciri ini terus ditekankan oleh keasidannya yang hebat. Akibatnya, karbokation adalah spesies yang sangat reaktif, yang hampir tidak terbentuk dan tidak lama lagi (dalam soal nanodoseconds) bertindak balas untuk menimbulkan produk sebenar reaksi kimia.
Boleh melayani anda: Asid sulfamik: struktur, sifat, sintesis, kegunaanJenis Carbocations
Terdapat beberapa jenis karbokati. Walau bagaimanapun, ini boleh diklasifikasikan seperti berikut:
-Utama
-Sekunder
-Tertiari
-Aromatik atau Arillos
-Vinil dan alilic
Utama
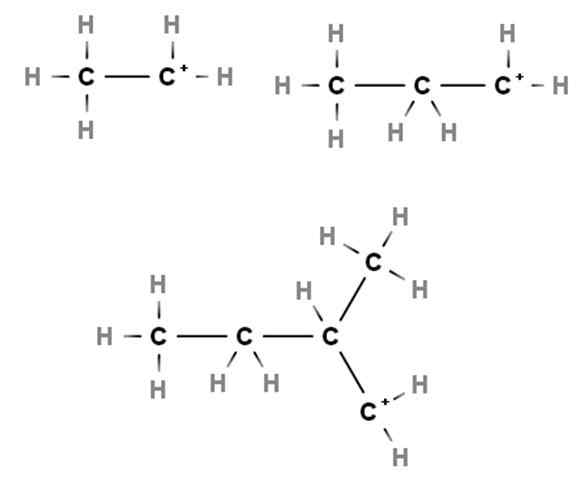 Carbocations utama. Sumber: Gabriel Bolívar melalui Molview.
Carbocations utama. Sumber: Gabriel Bolívar melalui Molview. Ketibaan menunjukkan contoh karbokati utama. Mereka dipanggil kerana beban positif terletak pada karbon utama, 1, jadi hanya dikaitkan dengan atom karbon. Etano, Ch3Ch3, Apabila H kehilangan mana -mana hujungnya, Carbocation Cho3Ch2+ Sama ada +Ch2Ch3.
Sekunder
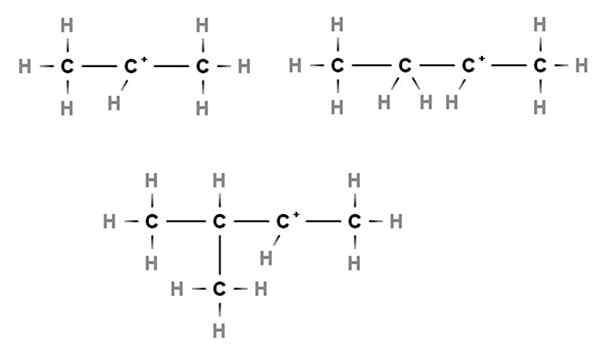 Carbocations sekunder. Sumber: Gabriel Bolívar melalui Molview.
Carbocations sekunder. Sumber: Gabriel Bolívar melalui Molview. Dalam karbokati sekunder, beban positif terletak di karbon sekunder, ke -2, yang dikaitkan dengan dua atom karbon. Contohnya, jika propana, cho3Ch2Ch3, Kami mengambil H dari karbon pusat, kami akan mempunyai carbocation cho3Ch2+Ch3.
Tertiari
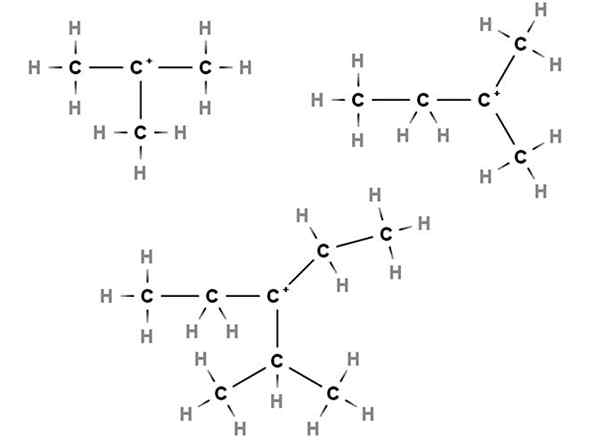 Carbocations Tertiary. Sumber: Gabriel Bolívar melalui Molview.
Carbocations Tertiary. Sumber: Gabriel Bolívar melalui Molview. Dalam karbokati tertiari beban positif terletak di karbon tersier, ke -3, dikaitkan dengan tiga atom karbon. Perhatikan bahawa tidak seperti dua jenis karbokati pertama, mereka kekurangan atom hidrogen.
Oleh itu, kita mempunyai methylpropane atau isobutane, ch (ch (pilih3)3, Yang dengan kehilangan hidrogen karbon pusat membentuk karbokasi +C (ch3)3.
Aromatik
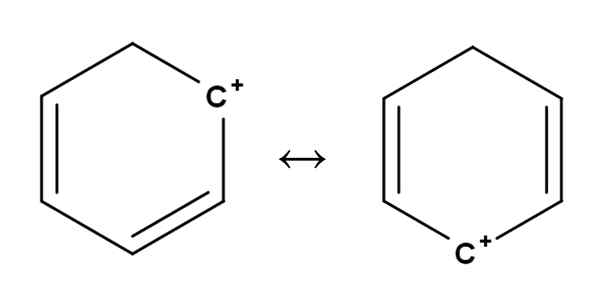 Benzene Carbocat. Sumber: Gabriel Bolívar.
Benzene Carbocat. Sumber: Gabriel Bolívar. Karbokation aromatik atau aromatik mungkin yang paling istimewa dari semua. Latihan anda sangat serupa dengan yang diterangkan untuk alkena di bahagian pertama.
Di dalamnya, beban positif terletak, pada dasarnya, di salah satu karbon cincin aromatik, seperti benzena. Walau bagaimanapun, beban positif tidak ditetapkan, tetapi tersebar di kedudukan cincin lain dengan resonans.
Ia boleh melayani anda: Ribulosa-1,5-biphosphate (RUBP): Ciri-ciri, KarbolixationIni adalah bagaimana beban positif, seperti yang dilihat di atas, berlalu dari satu karbon ke yang lain di dalam cincin benzena. Ciri ini memberikan kestabilan besar karbohidrat ini terhadap jenis karbokati lain.
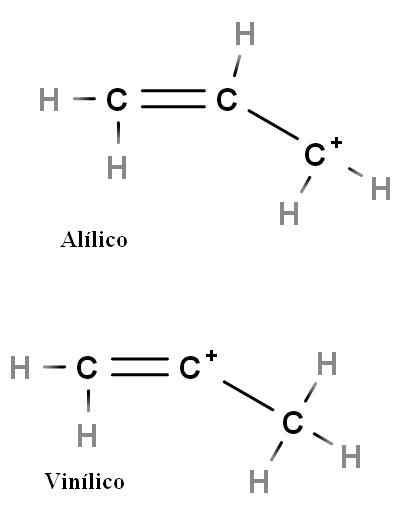
Allylic dan vinil
 Carbocation Allylic dan Vinyl. Sumber: Gabriel Bolívar.
Carbocation Allylic dan Vinyl. Sumber: Gabriel Bolívar. Jenis karbokati khas lain adalah alilic dan vinil. Perbezaan di antara mereka (di atas) adalah kedudukan caj positif yang berkaitan dengan ikatan berganda.
Dalam vinil karbokasi beban positif ditemui di salah satu karbon ikatan berganda; Semasa dalam karbokati allyic, beban positif terletak di karbon berikutan ikatan berganda. Cukup untuk mengganti hidrogen dengan kumpulan lain dan kami akan mempunyai keluarga besar dan vinil karbokation.
Kestabilan relatif
Mengetahui yang merupakan jenis utama karbokati, mereka boleh dipesan berdasarkan kestabilan relatif mereka:
Vinil < Primario < Secundario < Alílico < Terciario < Aromático
Sekarang, mungkin terdapat karbokati alis yang lebih stabil daripada tertiari tertentu. Semuanya bergantung pada substituen mereka.
Kenapa kestabilan ini? Keupayaan molekul untuk menyebarkan atau mengurangkan beban positif karbohidrat. Untuk melakukan ini, anda memerlukan atom dekat yang memberikan sebahagian daripada ketumpatan karbokati elektroniknya dengan hiperkonjugasi. Sementara itu, dalam karbokati alumik dan aromatik ini dicapai dengan resonans.
Dalam kes karbokati vinil, beban positif terletak pada karbon yang sudah sp2, yang menjadikannya sangat tidak stabil.
Rujukan
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Carbocation. Diperoleh dari: dalam.Wikipedia.org
- James Ashenhurst. (20 Februari 2020). 3 faktor yang menstabilkan karbokati. Pulih dari: masterorganicchemistry.com
- Clark Jim. (2000). Karbokati (atau ion karbonium). Pulih dari: chemguide.co.UK
- Dr. Kennepohl, prof. S. Petani & t. Soderberg. (10 Ogos 2020). Struktur dan kestabilan karbohidrat. Kimia Librettexts. Pulih dari: chem.Libretxts.org

