Struktur Karbonat Aluminium, Properties, Kegunaan
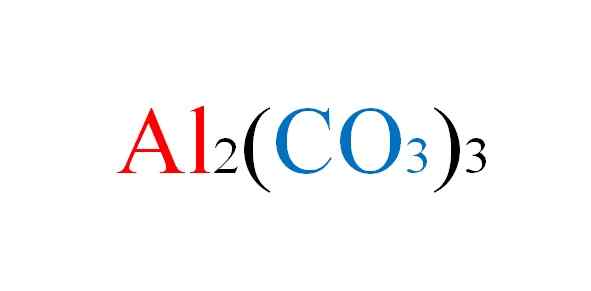
- 3666
- 767
- Ismael Turner
Dia Aluminium karbonat Ia adalah garam bukan organik yang formula kimia adalah2(Co3)3. Ia adalah karbonat logam yang tidak boleh dipercayai, memandangkan ketidakstabilan yang tinggi dalam keadaan normal.
Antara sebab ketidakstabilannya, kita dapat menyebut interaksi elektrostatik yang lemah antara ion ke3+ dan co32-, yang dalam teori harus sangat kuat untuk magnitud beban mereka.
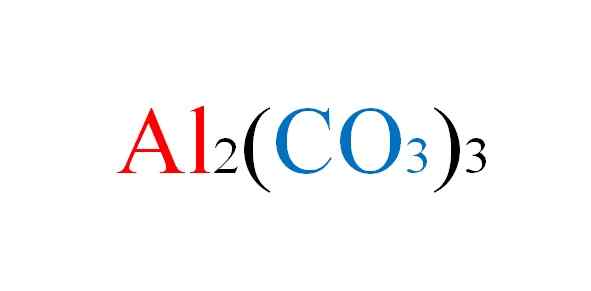 Formula Karbonat Aluminium. Sumber: Gabriel Bolívar.
Formula Karbonat Aluminium. Sumber: Gabriel Bolívar. Garam menghadapi sebarang kesulitan di dalam kertas apabila persamaan kimia reaksi mereka ditulis; Tetapi dalam praktiknya ia menentangnya.
Walaupun apa yang dikatakan, aluminium karbonat boleh berlaku di syarikat ion lain, seperti halnya dengan Dawsonite Mineral. Terdapat juga terbitan di mana ia berinteraksi dengan ammonia berair. Selebihnya, ia dianggap campuran antara al (oh)3 dan h2Co3; yang sama dengan penyelesaian effervescent dengan mendakan putih.
Campuran ini mempunyai penggunaan ubat. Walau bagaimanapun, kepada garam al yang tulen, terpencil dan dimanipulasi al2(Co3)3, Anda tidak diketahui aplikasi yang mungkin; Sekurang -kurangnya bukan tekanan besar atau keadaan yang melampau.
[TOC]
Struktur karbonat aluminium
Struktur kristal untuk garam ini tidak diketahui, kerana ia tidak stabil sehingga tidak dapat dicirikan. Dari formulanya hingga2(Co3)3, Walau bagaimanapun, diketahui bahawa perkadaran ion ke3+ dan co32- Ia adalah 2: 3; iaitu untuk setiap dua kation ke2+ Mesti ada tiga anion co32- berinteraksi secara elektrostatik dengan mereka.
Masalahnya ialah kedua -dua ion sangat tidak sama dengan saiz mereka; Al3+ Ia sangat kecil sementara co32- Ia besar. Perbezaan ini dengan sendirinya sudah mempengaruhi kestabilan reticular rangkaian kristal, yang ionnya akan berinteraksi "canggung" jika garam ini dalam keadaan pepejal diasingkan.
Ia boleh melayani anda: Nombor Avogadro: Sejarah, Unit, Bagaimana Ia Dikira, KegunaanSebagai tambahan kepada aspek ini, al3+ Ia adalah kation yang sangat polarisasi, harta yang mengubah bentuk awan elektronik CO32-. Seolah -olah dia mahu memaksanya untuk menghubungkan kovalen, walaupun anion tidak dapat melakukannya.
Oleh itu, interaksi ionik antara al3+ dan co32- Mereka cenderung ke arah kovalensi; Faktor lain yang menambah ketidakstabilan al2(Co3)3.
Ammonium aluminium karbonat hidroksida
Hubungan huru -hara antara al3+ dan co32- Ia melembutkan penampilan apabila terdapat ion lain yang terdapat di dalam kaca; seperti NH4+ Dan oh-, dari penyelesaian ammonia. Kuartet ion ini, ke3+, Co32-, NH4+ Dan oh-, Mereka berjaya menentukan kristal yang stabil, walaupun mampu mengadopsi morfologi yang berbeza.
Satu lagi contoh yang serupa dengan ini diperhatikan dalam mineral Dawsonite dan kristal ortorrombiknya, Naalco3(Oh)2, Di mana na+ Ganti NH4+. Dalam garam ini ikatan ionik mereka cukup kuat sehingga air tidak mempromosikan pelepasan CO2; atau sekurang -kurangnya tidak tiba -tiba.
Walaupun NH4Al (oh)2Co3 (AACC, untuk Sigles dalam Bahasa Inggeris), atau Naalco3(Oh)2 Mereka mewakili aluminium karbonat, mereka boleh dianggap sebagai derivatif asas yang sama.
Sifat
Jisim molar
233.98 g/mol.
Ketidakstabilan
Di bahagian sebelumnya ia dijelaskan dari perspektif molekul mengapa al2(Co3)3 Ia tidak stabil. Tetapi apa transformasi yang menderita? Anda mesti mempertimbangkan dua situasi: satu kering, dan yang lain "basah".
Kering
Dalam keadaan kering, anion co32- CO dibalikkan2 Melalui penguraian berikut:
Kepada2(Co3)3 => Al2Sama ada3 + 3co2
Ia boleh melayani anda: Kalsium fosfat (CA3 (PO4) 2)Yang masuk akal jika ia disintesis di bawah alumina kepada tekanan besar CO2; iaitu reaksi terbalik:
Kepada2Sama ada3 + 3co2 => Al2(Co3)3
Oleh itu, untuk mengelakkan menguraikan al2(Co3)3 Anda mesti menghantar garam ke tekanan hebat (menggunakan n2, Sebagai contoh). Dengan cara ini pembentukan Co2 tidak akan disukai termodinamik.
Basah
Semasa berada dalam keadaan basah, CO32- Ia menderita hidrolisis, yang menghasilkan sejumlah kecil oh-; Tetapi cukup untuk aluminium hidroksida untuk mendakan, di (oh)3:
Co32- + H2Atau HCO3- + Oh-
Kepada3+ + 3oh- Al (oh)3
Dan sebaliknya, al3+ Ia juga dihidrolisis:
Kepada3+ + H2Atau ke (oh)22+ + H+
Walaupun ia benar -benar akan terhidrasi3+ Untuk membentuk kompleks (h2Sama ada)63+, yang dihidrolisiskan untuk memberi [kepada (h2Sama ada)5Oh]2+ dan h3Sama ada+. Kemudian, h3Atau (atau h+) Protona ke co32- ke h2Co3, yang runtuh ke co2 dan h2Sama ada:
Co32- + 2h+ => H2Co3
H2Co3 Co2 + H2Sama ada
Perhatikan bahawa pada akhirnya Al3+ Ia berkelakuan seperti asid (lepaskan h+) dan pangkalan (melepaskan OH- Dengan keseimbangan kelarutan Al (OH)3); iaitu, ia mempamerkan amphoterism.
Fizikal
Untuk dapat mengasingkannya sendiri, garam ini mungkin putih, seperti garam aluminium lain. Juga, disebabkan perbezaan antara radio ionik Al3+ dan co32-, Pasti ia akan mempunyai titik lebur atau mendidih yang sangat rendah berbanding dengan sebatian ionik yang lain.
Ia boleh melayani anda: Benchilo: Benzyl Hydrogens, Carbocations, Benzyl RadicalsDan mengenai kelarutannya, ia akan larut dalam air. Di samping itu, ia akan menjadi pepejal hygroscopic dan lazat. Walau bagaimanapun, ini hanya ramalan. Ciri -ciri lain perlu dianggarkan dengan model pengiraan tertakluk kepada tekanan tinggi.
Aplikasi
Aplikasi yang diketahui dari aluminium karbonat adalah perubatan. Ia digunakan sebagai astringen lembut dan sebagai ubat untuk merawat keradangan dan ulser gastrik. Ia juga telah digunakan untuk mencegah pembentukan pengiraan kencing pada manusia.
Ia telah digunakan untuk mengawal peningkatan kandungan badan fosfat dan juga untuk merawat gejala keasidan perut, senak asid dan ulser perut.
Rujukan
- Xuehui l., Zhe t., Yongming c., Ruiyu z. & Chenguang l. (2012). Sintesis hidroterma ammonium aluminium karbonat hidroksida (AACH) nanoplatelets dan nanofibers morfologi pH yang dikawal. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammonium aluminium karbonat hidroksida NH4al (OH) 2CO3 sebagai laluan alternatif untuk penyediaan aluminium: perbandingan dengan prekursor klasik. Teknologi Serbuk, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Aluminium karbonat. Pangkalan data PUBCHEM., CID = 1035396. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2019). Aluminium karbonat. Diperoleh dari: dalam.Wikipedia.org
- Aluminumsulfate. (2019). Aluminium karbonat. Pulih dari: aluminiumsulfate.jaring

