Karbon

- 2300
- 488
- Clarence Greenholt DDS
Apa itu Karbon?
Dia Karbon Ia adalah elemen kimia bukan logam yang simbol kimianya adalah c. Namanya disebabkan oleh arang batu, sayur atau mineral, di mana atomnya menentukan pelbagai struktur. Ia membentuk pelbagai sebatian organik dan bukan organik, dan juga membentangkan dirinya dalam sejumlah besar alotropes.
Karbon ditemui di semua makhluk hidup; Semua biomolekulnya berhutang kepada kestabilan dan kekuatan ikatan C-C dan kecenderungannya yang tinggi untuk menyatukan. Ia adalah unsur kehidupan, dan dengan atom mereka badan mereka dibina.
Sebatian organik dengan biomaterial yang dibina terdiri daripada kerangka berkarbonat dan heteroatomes. Ini dapat dilihat pada pandangan pertama di kayu pokok; Dan juga, ketika kilat jatuh ke atas mereka dan Rostiza. Baki pepejal hitam lengai juga mempunyai karbon; Tetapi ia adalah arang.
Sifat karbon
Ciri -ciri fizikal atau kimia yang terdapat dalam pepejal, mineral atau bahan karbon adalah tertakluk kepada banyak pembolehubah. Antaranya ialah: komposisi atau tahap kekotoran, hibridasi atom karbon, kepelbagaian struktur, dan morfologi atau saiz liang.
Apabila sifat karbon menggambarkan, majoriti teks atau sumber bibliografi berdasarkan grafit dan berlian.
Kerana? Kerana mereka adalah alotropes yang paling terkenal untuk elemen ini dan mewakili pepejal atau bahan kesucian yang tinggi; iaitu, mereka praktikal tidak membuat apa -apa selain atom karbon (walaupun dengan struktur yang berbeza, seperti yang dijelaskan di bahagian berikut).
Sifat -sifat arang batu sayur dan mineral berbeza dalam asal -usul atau komposisi mereka. Sebagai contoh, lignite (karbon miskin) sebagai bahan bakar gatea berbanding antrasit (karbon kaya). Dan apa yang hendak dikatakan mengenai Alotropes yang lain: nanotube, fullerenos, graphene, graphos, dll.
Walau bagaimanapun, mereka secara kimia mempunyai titik yang sama: mereka mengoksidakan dengan lebihan oksigen di CO2:
C + Sama ada2 => Co2
Sekarang, kelajuan atau suhu yang mereka perlukan untuk mengoksidakan adalah untuk setiap alotrop ini.
Graphite vs Diamond
Di sini komen ringkas juga akan dibuat mengenai sifat -sifat yang berbeza untuk kedua -dua alotrop ini:
 Jadual di mana beberapa sifat dua alotrop kristal karbon dibandingkan. Sumber: Gabriel Bolívar.
Jadual di mana beberapa sifat dua alotrop kristal karbon dibandingkan. Sumber: Gabriel Bolívar. Struktur dan konfigurasi elektronik
Hibridasi
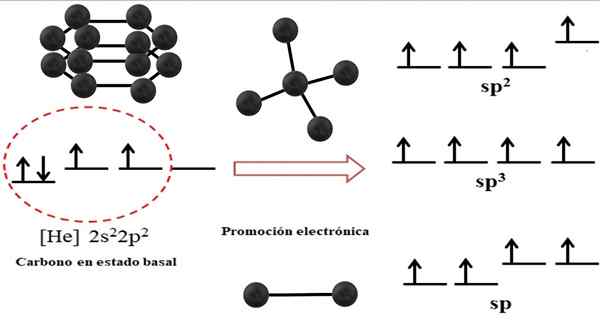 Hubungan antara orbital hibrid dan struktur yang mungkin untuk karbon. Sumber: Gabriel Bolívar.
Hubungan antara orbital hibrid dan struktur yang mungkin untuk karbon. Sumber: Gabriel Bolívar. Konfigurasi elektronik untuk atom karbon adalah 1s22s22 p2, juga ditulis sebagai [dia] 2s22 p2 (gambar atas). Perwakilan ini sepadan dengan status basalnya: atom karbon yang diasingkan dan digantung dalam vakum yang tidak dapat berinteraksi dengan orang lain.
Boleh melayani anda: struktur kristalAdalah dihargai bahawa salah satu daripada orbital 2pnya kekurangan elektron, yang menerima elektron orbital tenaga yang lebih rendah oleh promosi elektronik; Dan dengan itu, atom memperoleh keupayaan untuk membentuk sehingga empat ikatan kovalen melalui empat orbital hibrid SP3.
Perhatikan bahawa empat orbitals sp sp3 Mereka degenerasi tenaga (diselaraskan pada tahap yang sama). Orbital p Murni lebih bertenaga, itulah sebabnya mereka berada di atas orbital hibrid lain (di sebelah kanan imej).
Sekiranya terdapat tiga orbital hibrid, itu adalah kerana sisa orbital p tanpa hibridasi; Oleh itu, mereka adalah tiga orbital SP2. Dan apabila terdapat dua orbital hibrid ini, dua orbital p Mereka boleh membentuk ikatan berganda atau tiga, sebagai hibridisasi karbon f.
Aspek elektronik sedemikian penting untuk memahami mengapa karbon dapat ditemui dalam infiniti alotropes.
Nombor pengoksidaan
Sebelum meneruskan struktur, bukan orang lain untuk menyebutnya, memandangkan konfigurasi elektronik Valencia 2s22 p2, Karbon boleh mempunyai nombor pengoksidaan berikut: +4, +2, 0, -2 dan -4.
Kerana? Nombor -nombor ini sesuai dengan anggapan bahawa terdapat ikatan ionik supaya anda membentuk ion dengan beban masing -masing; iaitu, c4+, C2+, C0 (neutral), c2- dan c4-.
Untuk karbon mempunyai nombor pengoksidaan positif, ia mesti kehilangan elektron; Dan untuk melakukannya, semestinya harus dikaitkan dengan atom elektronegatif (seperti oksigen).
Sementara itu, untuk karbon mempunyai nombor pengoksidaan negatif, ia mesti mendapat elektron yang menghubungkan ke logam atau kurang atom elektronegatif daripada dia (seperti hidrogen).
Isu pengoksidaan pertama, +4, bermakna karbon telah kehilangan semua elektron valensi; Orbitals 2s dan 2p kosong. Jika orbital 2p kehilangan dua elektron, karbon akan mempunyai nombor pengoksidaan +2; Jika anda memenangi dua elektron, anda akan mempunyai -2; Dan jika dia memenangi dua elektron lebih banyak menyelesaikan oktetnya dari Valencia, -4.
Contoh
Contohnya, untuk Co2 Nombor pengoksidaan karbon adalah +4 (kerana oksigen lebih elektronegatif); Semasa untuk Cho4, adalah -4 (kerana hidrogen kurang elektronegatif).
Boleh melayani anda: Hydrazine: struktur, sifat, sintesis, kegunaanUntuk ch3Oh, nombor pengoksidaan karbon ialah -2 (+1 untuk H dan -2 untuk O); Sementara untuk hcooh, ia adalah +2 (periksa bahawa jumlah 0).
Negara pengoksidaan lain, seperti -3 dan +3, juga mungkin, terutamanya apabila ia datang kepada molekul organik; Sebagai contoh, dalam kumpulan metil, -ch3.
Geometri molekul
Dalam imej yang unggul, bukan sahaja hibridisasi orbital untuk atom karbon ditunjukkan, tetapi juga geometri molekul yang dihasilkan apabila beberapa atom (sfera hitam) dikaitkan dengan pusat. Atom pusat ini untuk melupuskan persekitaran geometri tertentu di ruang angkasa, mesti memiliki hibridisasi kimia masing -masing yang dibenarkan.
Sebagai contoh, untuk tetrahedron, karbon pusat mempunyai hibridisasi SP3; Kerana itu adalah susunan yang paling stabil untuk empat hibrid sp3. Dalam kes karbon SP2, Mereka boleh membentuk pautan berganda dan melupuskan persekitaran rata trigonal; Oleh itu, segitiga ini menentukan segi enam yang sempurna. Dan untuk hibridisasi SP, karbon mengamalkan geometri linear.
Oleh itu, geometri yang diperhatikan dalam struktur semua alotrop hanya ditadbir di tetrahedra (SP3), heksagon atau pentagon (SP2), dan garis (sp).
Tetrahedra mentakrifkan struktur 3D, manakala heksagon, pentagon dan garis, struktur 3d atau 2d; Yang terakhir menjadi pesawat atau lembaran yang serupa dengan dinding lebah lebah lebah:
 Dinding dengan reka bentuk heksagon lebah lebah lebah dalam analogi dengan pesawat yang terdiri daripada karbon SP2. Sumber: Pixabay.
Dinding dengan reka bentuk heksagon lebah lebah lebah dalam analogi dengan pesawat yang terdiri daripada karbon SP2. Sumber: Pixabay. Dan jika kita melipat dinding heksagon ini (pentagonal atau bercampur), kita akan memperoleh tiub (nanotubes) atau bola (fullerene), atau angka lain. Interaksi antara angka -angka ini menimbulkan morfologi yang berbeza.
Pepejal amorf atau kristal
Meninggalkan geometri, hibridisasi, atau morfologi struktur karbon yang mungkin, pepejal mereka dapat mengklasifikasikan secara global menjadi dua jenis: amorf atau kristal. Dan di antara kedua -dua klasifikasi ini alotrop mereka diedarkan.
Karbon amorf adalah hanya yang membentangkan campuran tetrahedra, heksagon atau garis sewenang -wenangnya, tidak dapat menubuhkan corak struktur; Begitu juga dengan arang batu, sayur -sayuran atau diaktifkan arang batu, kok, jelaga, dll.
Manakala karbon kristal terdiri daripada corak struktur yang dibentuk oleh mana -mana geometri yang dibangkitkan; Contohnya, Diamond (Rangkaian Tetrahedra Tiga -Dimensi) dan Grafit (Susun Hexagonal Helpon).
Boleh melayani anda: natrium nitrat (nano3): struktur, sifat, kegunaan, risikoDi mana karbon?
Di samping menjadi elemen kimia yang biasa dalam semua bentuk kehidupan, sifat karbon hadir dalam tiga bentuk kristal: berlian, grafit dan panduan.
Terdapat juga beberapa bentuk mineral arang batu amorf (anthracite, lignite, bisu, gambut), bentuk cecair (jenis petroleum) dan soda (gas asli).
Aplikasi
Sekali lagi, seperti sifat dan struktur, kegunaan atau aplikasi selaras dengan alotrogos atau bentuk karbon mineralogi. Walau bagaimanapun, terdapat beberapa umum yang boleh disebutkan, sebagai tambahan kepada beberapa perkara yang sangat diketahui. Begitu:
-Karbon telah digunakan untuk masa yang lama sebagai ejen pengurangan mineral dalam mendapatkan logam tulen; Sebagai contoh, besi, silikon dan fosforus, antara lain.
-Ini adalah asas kehidupan, dan kimia organik dan biokimia adalah kajian renungan ini.
-Ia juga menjadi bahan bakar fosil yang membolehkan mesin pertama pergi ke gear mereka. Dengan cara yang sama, gas karbon untuk sistem pencahayaan lama diperoleh daripadanya. Batu arang sinonim dengan cahaya, panas dan tenaga.
-Campuran sebagai aditif dengan besi dalam perkadaran yang berbeza membolehkan ciptaan dan peningkatan keluli.
-Warna hitamnya berlaku dalam seni, terutamanya grafit dan semua tulisan yang dibuat dengan strok mereka.
Risiko dan langkah berjaga -jaga
Karbon dan pepejalnya tidak mewakili risiko kesihatan. Siapa yang bimbang dengan beg arang batu? Mereka menjualnya ke dalam dewan beberapa pasaran, dan selagi tidak ada api dekat, blok hitam mereka tidak akan terbakar.
Coke, sebaliknya, boleh mewakili risiko jika kandungan sulfurnya tinggi. Apabila pembakaran akan melepaskan gas belerang yang, sebagai tambahan kepada toksik, menyumbang kepada hujan asid. Dan walaupun CO2 Dalam kuantiti yang kecil, ia tidak dapat mencekik kita, ia memberi impak besar kepada alam sekitar sebagai gas rumah hijau.
Dari perspektif ini, Karbon adalah bahaya "panjang", kerana pembakarannya mengubah iklim planet kita.
Dan dalam erti kata yang lebih fizikal, pepejal atau bahan karbon jika mereka disembur mudah diangkut oleh arus udara; Dan akibatnya, mereka diperkenalkan terus ke paru -paru, yang boleh merosakkannya.
Selebihnya, sangat biasa untuk mengambil "arang batu" ketika makanan memasak.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.

