Jenis keton, sifat, tatanama, kegunaan, contoh
- 3137
- 879
- Dallas Bernhard
The Ketones Mereka adalah sebatian organik yang mempunyai kumpulan karbonil (-co). Mereka adalah sebatian mudah di mana karbon karbonil kumpulan dikaitkan dengan dua atom karbon (dan rantai substituen mereka)). Keton adalah "mudah" kerana mereka tidak mempunyai kumpulan reaktif seperti -OH atau -cl bersatu dengan karbon.
Diiktiraf sebagai sebatian kutub, keton biasanya larut dan tidak menentu, yang menjadikan mereka pelarut dan aditif yang baik untuk minyak wangi. Di samping itu, mereka mudah disediakan, agak stabil dan mempunyai kereaktifan yang tinggi, yang menjadikan mereka sebatian perantaraan yang hampir sempurna untuk menyediakan sebatian organik yang lebih kompleks.
 Formula Keton Umum
Formula Keton Umum Akhir.
[TOC]
Formula Keton Umum
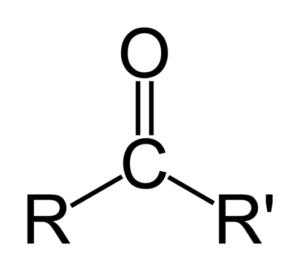
Keton adalah sebatian karbonil di mana kumpulan ini dikaitkan dengan dua kumpulan hidrokarbon; Ini boleh menjadi kumpulan alkil, kumpulan cincin benzena atau kedua -duanya.
Sebuah keton boleh diwakili hanya sebagai r- (c = o) -r ', di mana r dan r' adalah dua rantai mana -mana hidrokarbon (alko, alkenes, alkin, sikloalcanos, derivatif benzena dan lain -lain). Tidak ada keton dengan hidrogen yang dilampirkan pada kumpulan karbonil.
Terdapat pelbagai kaedah untuk penyediaan keton dalam bidang perindustrian dan makmal; Di samping itu, adalah penting untuk diperhatikan bahawa keton boleh disintesis oleh organisma yang berbeza, termasuk manusia.
Dalam industri, kaedah yang paling biasa untuk sintesis keton melibatkan pengoksidaan hidrokarbon, biasanya dengan penggunaan udara. Secara kecil, keton biasanya disediakan melalui pengoksidaan alkohol sekunder, yang memberikan produk cetona dan air sebagai produk.
Di luar kaedah yang paling biasa ini, keton boleh disintesis melalui alkena, alkena, garam sebatian nitrogen, ester dan banyak sebatian lain, yang menjadikannya mudah diperoleh.
Jenis keton
Terdapat beberapa klasifikasi untuk keton, bergantung terutamanya kepada substituen dalam rantai R mereka. Klasifikasi yang paling biasa untuk bahan -bahan ini dilantik di bawah:
Menurut struktur rantai
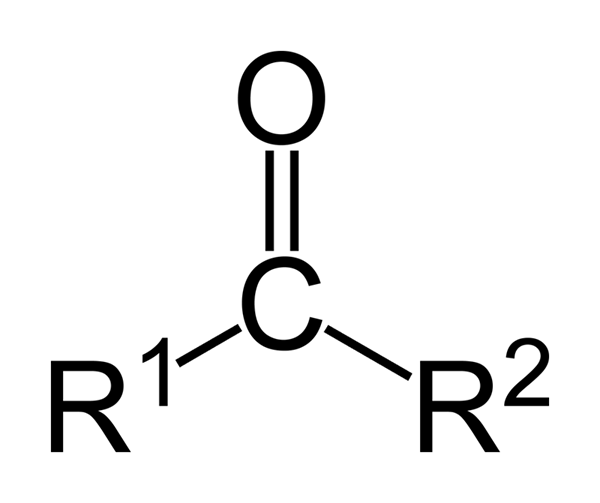
Dalam kes ini, keton diklasifikasikan dengan cara di mana rantainya berstruktur: keton alifatik adalah mereka yang mempunyai dua r dan r radikal yang mempunyai bentuk alkil radikal (alkana, alkenes, alkin dan sikloalcanos).
Ia boleh melayani anda: Isoamil Alkohol: Struktur, Sifat, Kegunaan dan RisikoSebaliknya, aromatik adalah mereka yang membentuk derivatif benzena, sementara masih menjadi keton. Akhirnya, keton bercampur adalah mereka yang mempunyai r 'aril radikal, atau sebaliknya.
 Dari kiri ke kanan: Propanona, benzofrona dan phenylmetilbutanone. Wikimedia Commons Images.
Dari kiri ke kanan: Propanona, benzofrona dan phenylmetilbutanone. Wikimedia Commons Images. Menurut simetri radikal mereka
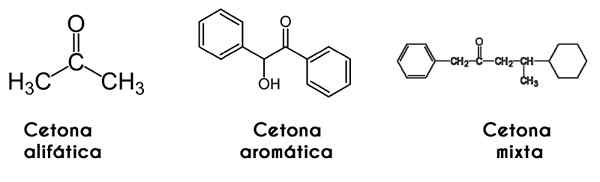
Dalam kes ini, radikal R dan R dikaji oleh kumpulan karbonil; Apabila ini adalah sama (identik) ketone menyebut dirinya simetri; Tetapi apabila mereka berbeza (seperti kebanyakan keton), ia menyebut dirinya tidak simetris.
 Imej melalui Wikimedia Commons.
Imej melalui Wikimedia Commons. Menurut ketepuan radikalnya
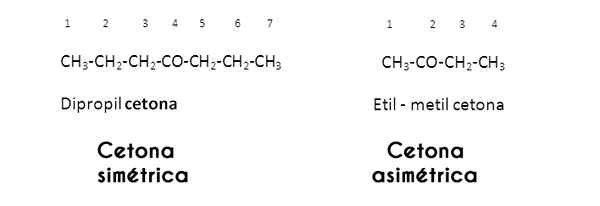
Ketones juga boleh diklasifikasikan mengikut tepu rantai karbon mereka; Sekiranya ini dalam bentuk alkana, ketone memanggil dirinya keton tepu. Sebaliknya, jika rantai seperti alkena atau alkina, keton dipanggil keton tak tepu.
 Di sebelah kiri, acetylene kanan. Imej melalui Wikimedia Commons.
Di sebelah kiri, acetylene kanan. Imej melalui Wikimedia Commons. Dicetones
Ini adalah kelas selain Cetona, kerana rantai keton ini mempunyai dua kumpulan karbonil dalam strukturnya. Sebahagian daripada keton ini mempunyai ciri -ciri yang unik, seperti panjang pautan yang lebih besar antara karbon.
Sebagai contoh, dicetones yang berasal dari sikloheksa dikenali sebagai quinonas, yang hanya dua: ortho-benzoquinone dan benzoquinone.
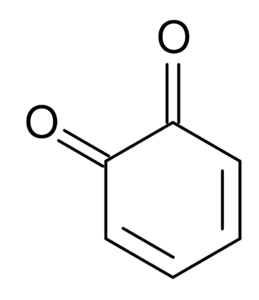 Ortho-Benzoquinone. Selatan di Bahasa Inggeris Wikipedia / Domain Awam
Ortho-Benzoquinone. Selatan di Bahasa Inggeris Wikipedia / Domain Awam Sifat fizikal dan kimia keton
Keton, seperti kebanyakan aldehid, adalah molekul cecair dan mempunyai siri sifat fizikal dan kimia yang berbeza -beza bergantung pada panjang rantai mereka. Sifatnya diterangkan di bawah:
Takat didih
Ketones sangat tidak menentu, kutub dan tidak dapat mendermakan hidrogen untuk ikatan hidrogen (mereka tidak mempunyai atom hidrogen yang terikat dengan kumpulan karbonil mereka), jadi mereka mempunyai titik mendidih yang lebih tinggi daripada alkena dan eter, tetapi lebih rendah daripada alkohol yang sama dengan berat molekul yang sama.
Titik mendidih keton meningkat apabila saiz molekul meningkat. Ini disebabkan oleh campur tangan van der Waals dan kuasa dipolo-dipolo, yang memerlukan tenaga yang lebih besar untuk memisahkan atom dan elektron tertarik dalam molekul.
Kelarutan
Kelarutan keton mempunyai pengaruh yang kuat di sebahagian daripada kapasiti molekul ini untuk menerima hidrogen dalam atom oksigen mereka dan dengan itu membentuk ikatan hidrogen dengan air. Di samping itu, daya tarikan, penyebaran dan dipole-dipole antara keton dan air, yang meningkatkan kesan larut mereka adalah daya.
Boleh melayani anda: besi (elemen): ciri, struktur kimia, kegunaanKetones kehilangan kapasiti kelarutan semakin besar molekul mereka, kerana mereka mula memerlukan lebih banyak tenaga untuk dibubarkan di dalam air. Mereka juga larut dalam sebatian organik.
Keasidan
Terima kasih kepada kumpulan karbonil mereka, keton mempunyai sifat berasid; Ini berlaku kerana kapasiti penstabilan resonans yang dimiliki oleh kumpulan berfungsi ini, yang dapat memberikan proton ikatan ganda untuk membentuk pangkalan konjugasi yang disebut enol.
Reaktiviti
Ketones adalah sebahagian daripada sejumlah besar tindak balas organik; Ini berlaku kerana kerentanan karbon karbonyl ke arah penambahan nukleofilik, sebagai tambahan kepada polaritas ini.
Seperti yang dinyatakan di atas, kereaktifan besar keton dibuat oleh produk perantaraan yang diiktiraf yang berfungsi sebagai asas untuk mensintesis sebatian lain.
Nomenclature
Ketones dinamakan mengikut keutamaan atau kepentingan kumpulan karbonil dalam keseluruhan molekul, jadi apabila anda mempunyai molekul yang ditadbir oleh kumpulan karbonyl, ketone dinamakan dengan menambahkan akhiran "-ona" kepada nama hidrokarbon.
Ia mengambil masa sebagai rantaian utama yang mempunyai panjang yang lebih besar yang dimiliki oleh kumpulan karbonil, dan kemudian molekul dinamakan. Jika kumpulan karbonil tidak mempunyai keutamaan ke atas kumpulan fungsional lain molekul, maka ia dikenal pasti dengan "-oxo".
Untuk keton yang lebih rumit, kedudukan kumpulan berfungsi dapat dikenalpasti dengan nombor, dan dalam hal diceton (keton dengan dua substituen r dan r 'identik), molekul dinamakan dengan akhiran "-diona".
Akhirnya, perkataan "cetona" juga boleh digunakan setelah mengenal pasti rantai radikal yang dikaitkan dengan kumpulan fungsi karbonil.
Perbezaan antara aldehid dan keton
Perbezaan terbesar antara aldehid dan keton adalah kehadiran atom hidrogen yang dilampirkan pada kumpulan karbonil di aldehida.
Atom ini mempunyai kesan penting apabila melibatkan molekul dalam tindak balas pengoksidaan: aldehid akan membentuk asid karboksilik atau garam asid karboksilik, bergantung kepada sama ada pengoksidaan berlaku di bawah asid atau keadaan asas di bawah asid atau keadaan asas.
Sebaliknya, cetona tidak mempunyai hidrogen ini, jadi langkah minimum yang diperlukan untuk pengoksidaan tidak berlaku.
Terdapat kaedah untuk mengoksidakan keton (dengan ejen pengoksidaan jauh lebih kuat daripada yang biasanya digunakan), tetapi mereka memecahkan molekul cetone, memisahkannya terlebih dahulu menjadi dua atau lebih bahagian.
Boleh melayani anda: Pengionan dalam Fizik dan Kimia: Konsep, Proses dan ContohnyaPenggunaan Kehidupan Perindustrian dan Harian
Dalam industri, keton diperhatikan dalam minyak wangi dan lukisan, mengambil kertas menstabilkan dan kondom yang menghalang komponen lain campuran daripada merendahkan; Mereka juga mempunyai spektrum yang luas sebagai pelarut dalam industri yang mengeluarkan bahan peledak, lukisan dan tekstil, sebagai tambahan kepada farmaseutikal.
Aseton (keton terkecil dan lebih kecil) adalah dunia pelarut yang sangat baik.
Secara semula jadi, keton boleh muncul sebagai gula, yang dipanggil ketuses. Ketosas adalah monosakarida yang mengandungi cetona dengan molekul. Ketose yang paling terkenal adalah fruktosa, gula yang terdapat dalam buah -buahan dan madu.
Biosintesis asid lemak yang berlaku di dalam sitoplasma sel haiwan juga berlaku oleh tindakan keton. Akhirnya, dan seperti yang disebutkan di atas, mungkin terdapat ketinggian keton dalam darah selepas berpuasa atau dalam kes diabetes.
Contoh keton
Butanona (C4H8Sama ada)
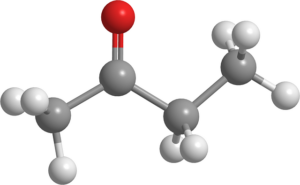 Molekul butanone. Sumber: Pixabay.
Molekul butanone. Sumber: Pixabay. Juga dikenali sebagai MEK (atau MEC), cecair ini dihasilkan secara besar -besaran dalam industri dan digunakan sebagai pelarut.
Cyclohexanone (c6H10Sama ada)
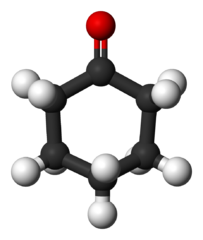 Molekul sikloheksanon. Benjah-bmm27 / domain awam
Molekul sikloheksanon. Benjah-bmm27 / domain awam Dihasilkan secara besar -besaran, keton ini digunakan sebagai pendahulu kepada bahan sintetik nilon.
Testosteron (c19H22Sama ada2)
 Molekul testosteron. Wikimedia Commons
Molekul testosteron. Wikimedia Commons Ia adalah hormon utama seks lelaki dan steroid anabolik, yang terdapat di kebanyakan vertebrata.
Progesteron (cdua puluh satuH30Sama ada2)
 Medroxiprogesterone acetate, komponen siklofemin
Medroxiprogesterone acetate, komponen siklofemin Steroid endogen dan hormon seksual yang terlibat dalam kitaran haid, kehamilan dan embriogenesis pada manusia dan spesies lain.
Aseton (Ch3(Co) ch3)
 Sebatian aseton. Benjah-bmm27 / domain awam
Sebatian aseton. Benjah-bmm27 / domain awam Juga dikenali sebagai propanona, ia adalah sebatian tanpa warna yang digunakan untuk pembuatan pelbagai produk perindustrian seperti plastik, serta untuk produk kebersihan rumah dan kosmetik seperti penyingkiran.
Cortisone (cdua puluh satuH28Sama ada5)
 Cortisone. Benjah-bmm27 / domain awam
Cortisone. Benjah-bmm27 / domain awam Hormon steroid yang digunakan untuk memerangi penyakit dan keadaan tertentu seperti keradangan, jerawat, alahan dan lain -lain jenis tindak balas kulit, asma atau kanser dan leukemia.
Benzofenona (c13H10Sama ada)
 Benzofenoma. Benjah-bmm27 / domain awam
Benzofenoma. Benjah-bmm27 / domain awam Kompaun digunakan secara meluas dalam penciptaan minyak wangi dan produk perlindungan kosmetik atau matahari yang lain kerana komposisi aromatiknya.
Rujukan
- Wikipedia. (s.F.). Ketone. Diperoleh dari dalam.Wikipedia.org
- Britannica, e. (s.F.). Ketone. Diperoleh dari Britannica.com
- Universiti, m. S. (s.F.). Aldehid dan keton. Diperoleh dari kimia.MSU.Edu
- Chemguide. (s.F.). Pengenalan Aldehid dan Ketones. Diperoleh dari chemguide.co.UK
- Calgary, u. Sama ada. (s.F.). Ketones. Diperoleh dari chem.Ucalgary.Ac

