Sifat berbasikal, tindak balas, kegunaan, contoh
- 874
- 72
- Donnie Ryan
The Cycloalcanos Mereka adalah keluarga hidrokarbon tepu dengan formula umum cnH2n Itu bertepatan dengan alkenes; dengan perbezaan bahawa ketidakpatuhan yang jelas tidak disebabkan oleh ikatan berganda, tetapi pada cincin atau kitaran. Itulah sebabnya mereka dianggap isomer Alquenos.
Ini terbentuk apabila alkana linear menyatukan hujung rantai mereka untuk berasal dari struktur tertutup. Seperti alkana, sikloalcan boleh mempamerkan saiz yang berbeza, massa molekul, penggantian atau sistem yang terdiri daripada lebih daripada satu cincin (polycyclicals).
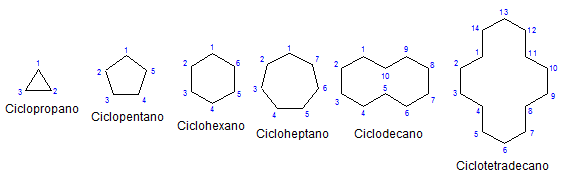
 Beberapa sikloalcanos monocyclic. Sumber: Mephisto Spa melalui Wikipedia.
Beberapa sikloalcanos monocyclic. Sumber: Mephisto Spa melalui Wikipedia. Selebihnya, kimia dan fizikal mereka serupa dengan alkana. Mereka hanya mempunyai karbon dan hidrogen, mereka adalah molekul neutral dan oleh itu berinteraksi melalui kuasa dinding van der. Mereka juga berfungsi sebagai bahan api, melepaskan haba ketika mereka terbakar dengan kehadiran oksigen.
Mengapa Cycloalcanos lebih tidak stabil daripada rakan rantaian terbuka mereka? Alasannya boleh disyaki dengan memerhatikan contoh -contoh sikloalka yang diwakili di atas imej: terdapat ketegangan dan halangan sterik (spatial).
Perhatikan bahawa karbon yang kurang (disenaraikan dalam warna biru), semakin tertutup strukturnya; Dan sebaliknya berlaku apabila mereka meningkat, berubah seperti kalung.
Cycloalcanos kecil adalah gas, dan sebagai saiz mereka meningkatkan daya intermolecular mereka. Oleh itu, mereka boleh menjadi cecair yang mampu membubarkan lemak dan apolar, pelincir, atau pepejal yang kelihatan warna gelap dan kualiti seperti warna asfalt.
[TOC]
Sifat fizikal dan kimia
Polariti
Apabila hanya terdiri daripada karbon dan hidrogen, atom -atom yang tidak terlalu berbeza dalam elektronegativiti, ini menjadikan molekul sikloalc apolar dan oleh itu kekurangan momen dipole.
Mereka tidak dapat berinteraksi melalui daya dipole-dipole, tetapi mereka bergantung khusus kepada kuasa London, yang lemah tetapi peningkatan dengan jisim molekul. Itulah sebabnya sikloalcanos kecil (dengan kurang daripada lima karbon) adalah gas.
Interaksi intermolecular
Sebaliknya, kerana mereka cincin, sikloalka mempunyai kawasan hubungan yang lebih besar, yang memihak kepada pasukan London di antara molekul mereka. Oleh itu, mereka dikelompokkan dan berinteraksi lebih baik berbanding dengan alkana; Dan oleh itu titik mendidih dan gabungannya lebih tinggi.
Juga, kerana mereka mempunyai dua atom hidrogen yang kurang (cnH2n Untuk sikloalka dan cnH2n+2 untuk alkana), mereka lebih ringan; Dan menambah ini hakikat kawasan hubungannya yang terbesar, mengurangkan jumlah yang diduduki oleh molekulnya, dan oleh itu, mereka lebih padat.
Ketepuan
Mengapa Cycloalcanos sebagai Hidrokarbon Tepek Dikelaskan? Kerana mereka mempunyai bagaimana mereka menggabungkan molekul hidrogen; Kecuali cincin dibuka, dan dalam hal ini mereka akan menjadi Alkanes Mudah. Untuk hidrokarbon dianggap tepu, ia mesti mempunyai bilangan maksimum pautan C-H.
Ia boleh melayani anda: potentiometer (fameter)Kestabilan
Secara kimia mereka sangat serupa dengan alkana. Kedua-duanya mempunyai pautan C-C dan C-H, yang tidak begitu mudah untuk dipecahkan untuk menyebabkan produk lain. Walau bagaimanapun, kestabilan relatif mereka berbeza, yang boleh disahkan secara eksperimen dengan mengukur pemanasan pembakaran mereka (ΔHsikat).
Contohnya, jika dibandingkan ΔHsikat Untuk propana dan cyclopropo (diwakili oleh segitiga dalam imej), terdapat 527.4 kcal/mol dan 498.9 kcal/mol, masing -masing.
Perinciannya ialah siklopropanesikat Minor (471 kcal/mol) kerana mereka adalah tiga kumpulan metilena, CHO2; Tetapi pada hakikatnya, ia mengeluarkan lebih banyak haba, mencerminkan ketidakstabilan lebih besar daripada yang dianggarkan. Tenaga berlebihan ini dikatakan bahawa ia disebabkan oleh ketegangan di dalam cincin.
Dan sebenarnya, ketegangan ini mentadbir dan membezakan kereaktifan atau kestabilan sikloalcanos, berkenaan dengan alkana, terhadap reaksi tertentu. Selagi ketegangan tidak terlalu tinggi, sikloalka cenderung lebih stabil daripada puncak masing -masing.
Nomenclature
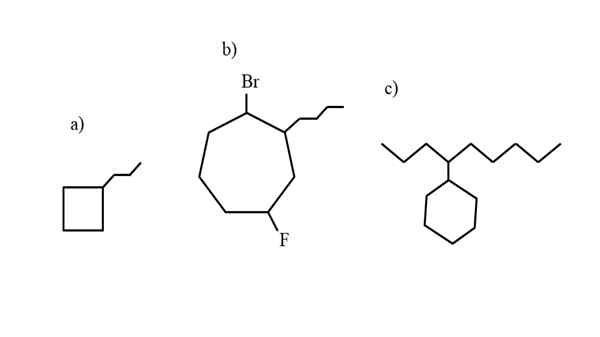 Beberapa contoh sikloalcan yang digantikan untuk menguji peraturan nomenklatur. Sumber: Gabriel Bolívar.
Beberapa contoh sikloalcan yang digantikan untuk menguji peraturan nomenklatur. Sumber: Gabriel Bolívar. Tatanama yang ditadbir oleh IUPAC untuk sikloalcanos tidak terlalu banyak daripada alkana. Peraturan yang paling mudah adalah meletakkan awalan kitaran- kepada nama alkane yang mana sikloalcano dibentuk.
Oleh itu, sebagai contoh, N-Hexane, CHO3Ch2Ch2Ch2Ch2Ch3, Cyclohexan diperoleh (diwakili oleh segi enam dalam imej pertama). Dengan cara yang sama ia berlaku dengan cyclopropane, cyclobutane, dll.
Sekarang, sebatian ini mungkin mengalami penggantian dari salah satu hidrogen mereka. Apabila bilangan karbon cincin lebih tinggi daripada substituen sewa, cincin itu diambil sebagai rantaian utama; Ini adalah kes a) untuk imej yang unggul.
Perhatikan bahawa dalam a) cyclobutane (dataran), mempunyai lebih banyak karbon daripada kumpulan ProPilus yang dikaitkan dengannya; Kemudian sebatian ini dinamakan sebagai propylciclobutano.
Sekiranya terdapat lebih daripada satu substituen, mereka harus dinamakan dalam susunan abjad dan sedemikian rupa sehingga mereka mempunyai nombor pencari yang paling mungkin. Sebagai contoh, b) dipanggil: 1-bromo-4-fluoro-2-butilcicloheptano (dan bukan 1-bromo-5-fluoro-7-butylcicloheptano, yang akan menjadi salah).
Dan akhirnya, apabila substituen alquil mempunyai lebih banyak karbon daripada cincin, dikatakan maka yang terakhir adalah kumpulan pengganti rantai utama. Oleh itu, c) dipanggil: 4-siklohexilnonano.
Boleh melayani anda: oksida logamStruktur
Mengetepikan siklus yang digantikan, mudah untuk memberi tumpuan hanya pada pangkalan struktur mereka: cincin. Ini diwakili dalam gambar pertama.
Apabila memerhatikannya, idea palsu mungkin timbul bahawa molekul sedemikian rata; Tetapi dengan pengecualian cyclopropo, permukaannya adalah "zigzagenantes", dengan karbon turun atau memuat naik berhubung dengan pesawat yang sama.
Ini kerana untuk memulakan semua karbon mempunyai hibridisasi SP3, dan oleh itu hadir geometri tetrahedral dengan sudut pautan 109.5º. Tetapi, jika geometri cincin diperhatikan dengan teliti, adalah mustahil untuk sudut mereka; Sebagai contoh, sudut dalam segitiga siklopropane adalah 60º.
Inilah yang dikenali sebagai ketegangan sudut. Semakin besar cincin, sudut antara pautan C-C lebih dekat dengan 109.5º, yang menyebabkan penurunan ketegangan sedemikian dan peningkatan kestabilan untuk sikloalcan.
Contoh lain diperhatikan dalam siklobutane, yang sudut pautannya adalah 90º. Sudah berada di siklopentano sudutnya adalah 108º, dan dari sikloheksan kemudian dikatakan bahawa ketegangan sudut berhenti untuk memberikan kesan seperti itu.
Penyesuaian
Sebagai tambahan kepada ketegangan sudut, terdapat faktor lain yang menyumbang kepada ketegangan yang dialami oleh sikloalcanos.
Pautan C-C tidak boleh berputar tanpa lebih, kerana ini akan menyiratkan bahawa keseluruhan struktur "gemetar". Oleh itu, molekul -molekul ini dapat mengguna pakai pengesahan spatial yang sangat jelas. Tujuan pergerakan ini adalah untuk mengurangkan ketegangan yang disebabkan oleh gerhana atom hidrogen; iaitu, ketika ada di hadapan yang lain.
Sebagai contoh, penyesuaian untuk cyclobutane menyerupai rama -rama yang mengalahkan sayapnya; orang -orang dari Cyclopentano, sampul surat; Orang -orang siklohexan, bot atau kerusi, dan lebih besar cincin, semakin besar bilangan dan bentuk yang dapat mereka pakai di ruang angkasa.
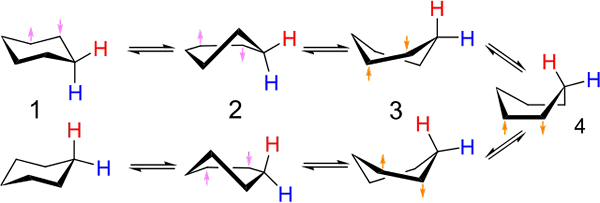 Pelaburan antara pengerusi dan jenis bot penyesuaian untuk sikloheksana. Sumber: Kministi [CC0].
Pelaburan antara pengerusi dan jenis bot penyesuaian untuk sikloheksana. Sumber: Kministi [CC0]. Imej unggul menunjukkan contoh penyesuaian sedemikian untuk sikloheksana. Perhatikan bahawa heksagon yang dikatakan rata kelihatan seperti kerusi (di sebelah kiri imej) atau bot (kanan). Hidrogen diwakili dengan lirik merah, dan satu lagi dengan lirik biru, untuk menunjukkan bagaimana kedudukan relatif mereka berubah selepas pelaburan.
Dalam (1), apabila hidrogen berserenjang dengan satah cincin, dikatakan bahawa ia berada dalam kedudukan paksi; Dan apabila selari dengan ini, dikatakan bahawa ia berada dalam kedudukan khatulistiwa.
Reaksi
Reaksi yang boleh diderita oleh Cycloalcan adalah sama seperti Alkanes. Kedua -duanya terbakar dengan kehadiran oksigen yang berlebihan dalam tindak balas pembakaran biasa untuk menghasilkan karbon dioksida dan air. Begitu juga, kedua -duanya mungkin mengalami halogenasi, di mana hidrogen digantikan oleh atom halogen (f, cl, br, i).
Ia boleh melayani anda: Kelebihan dan kekurangan kimia kesihatan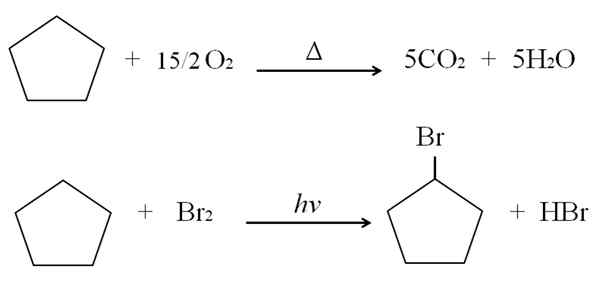 Reaksi Cyclopentano. Sumber: Gabriel Bolívar.
Reaksi Cyclopentano. Sumber: Gabriel Bolívar. Di atas reaksi pembakaran dan halogenasi untuk cyclopentano ditunjukkan sebagai contoh. Satu mole terbakar dengan kehadiran haba dan 7.5 tahi lalat oksigen molekul untuk memecah masuk ke Co2 dan h2Sama ada. Sebaliknya, di hadapan ultraviolet dan brome.
Aplikasi
Penggunaan cycloalcanos bergantung pada jumlah karbon mereka. Yang paling ringan, dan oleh itu gas, sekali berkhidmat untuk memberi makan lampu gas lampu awam.
Sementara itu, cecair mempunyai keuntungan sebagai pelarut minyak, lemak atau produk komersial sifat apolar. Antaranya anda boleh menyebut siklopentano, sikloheksan dan sikloheptane. Begitu juga, mereka sering digunakan dalam operasi rutin di makmal petróleos, atau dalam perumusan bahan api.
Sekiranya mereka lebih berat, mereka boleh digunakan sebagai pelincir. Sebaliknya, mereka juga boleh mewakili bahan permulaan untuk sintesis dadah; Seperti carboplatin, yang termasuk dalam strukturnya cincin siklobutane.
Contoh Cychannel
Akhirnya, ia dikembalikan ke permulaan artikel: Imej dengan beberapa sikloalcanos yang tidak ditekankan.
Untuk menghafal cycloalcanos, sudah cukup untuk memikirkan angka geometri: segitiga (siklopropane), persegi (siklobutane), pentagon (cyclopentano), heksagon.
Semakin besar cincin, semakin kurang ia menyerupai angka geometri masing -masing. Ia telah dilihat bahawa sikloheksan adalah segala -galanya tetapi segi enam; Perkara yang sama berlaku dengan lebih jelas dengan cyclootetradecano (empat belas karbon).
Titik datang di mana mereka akan berkelakuan seperti kalung yang boleh dilipat untuk mengurangkan ketegangan pautan dan gerhana mereka sepenuhnya.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Kimia Librettexts. (2 Jun, 2019). Menamakan Cycloalkanes. Pulih dari: chem.Libretxts.org
- Wikipedia. (2019). Cycloalkane. Diperoleh dari: dalam.Wikipedia.org
- Clark Jim. (2015). Memperkenalkan Alkaes dan Cycloalkanes. Pulih dari: chemguide.co.UK
- James Ashenhurst. (2019). Konformasi dan Cycloalkanes. Kimia Organik Master. Pulih dari: masterorganicchemistry.com
- Fernández Germán. (s.F.). Cycloalcanos-Toria. Kimia organik. Pulih dari: Chemicicaorganica.org

