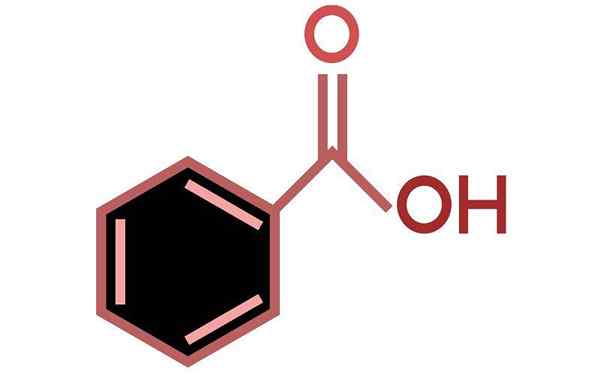
Asid benzoik (C6H5COOH)
- 639
- 0
- Kerry Schmitt
 Asid benzoik adalah asid karboksilik aromatik
Asid benzoik adalah asid karboksilik aromatik Apa itu asid benzoik?
Dia Asid benzoik Ia adalah asid aromatik yang paling mudah, mempunyai formula molekul c6H5COOH. Secara semula jadi ia terdapat di banyak tumbuhan, terutamanya dalam buah -buahan seperti aprikot dan blueberry. Ia juga berlaku dalam bakteria sebagai hasil sampingan metabolisme asid amino.
Ia dihasilkan dalam usus oleh pemprosesan bakteria (oksidatif) polifenol yang terdapat dalam beberapa makanan.
C6H5COOH adalah, tidak seperti banyak asid, sebatian pepejal, yang terdiri daripada kristal cahaya, putih dan filiform, yang mengeluarkan aroma badam dan ciri.
Salah satu keupayaan utama asid benzoik adalah untuk menghalang pertumbuhan ragi, acuan dan beberapa bakteria, jadi ia digunakan sebagai pengawet makanan.
Walaupun ia bukan sebatian toksik, ia mempunyai beberapa tindakan yang berbahaya untuk kesihatan. Oleh itu, yang mengesyorkan dos pengambilan maksimum 5 mg/kg berat badan/hari, bersamaan dengan pengambilan harian 300 mg asid benzoik.
Struktur asid benzoik
 Struktur asid benzoik. Sumber: Wikimedia Commons
Struktur asid benzoik. Sumber: Wikimedia Commons Imej unggul mewakili struktur asid benzoik dalam model bar dan sfera.
Sekiranya bilangan sfera hitam dikira, ia akan disahkan bahawa terdapat enam daripadanya, iaitu, enam atom karbon, dua sfera merah sesuai dengan dua atom oksigen kumpulan karboksil, -cooh, dan akhirnya, sfera putih adalah atom hidrogen.
Di sebelah kiri anda mempunyai cincin aromatik, yang aromatiknya digambarkan dengan garis -garis yang tidak berterusan di tengah cincin. Dan di sebelah kanan, kumpulan -COOH, yang bertanggungjawab untuk sifat asid sebatian ini.
Secara molekul, c6H5COOH mempunyai struktur rata, kerana semua atomnya (kecuali hidrogen) mempunyai hibridisasi SP2.
Sebaliknya, kumpulan -COOH, sangat kutub, membolehkan dipole kekal wujud dalam struktur.
Fakta ini menghasilkan c6H5COOH boleh berinteraksi dengan dirinya melalui pasukan dipole-dipolo. Khususnya, dengan jambatan hidrogen khas.
Sekiranya kumpulan -COOH diperhatikan, ia akan didapati bahawa oksigen C = o boleh menerima jambatan hidrogen, manakala oksigen O -H menyumbangkan mereka.
Jambatan kristal dan hidrogen
Asid benzoik boleh membentuk dua jambatan hidrogen: menerima dan menerima satu secara serentak. Oleh itu, ia membentuk dímeros, iaitu, molekulnya "berkaitan" dengan yang lain.
Ini adalah pasangan atau dimer, c6H5COOH-HOOCC6H5, asas struktur yang mentakrifkan pepejal yang terhasil daripada perancangannya di ruang angkasa.
Boleh melayani anda: elemen diatomikSifat fizikal dan kimia asid benzoik
Nama kimia
Asid:
-Benzoic
-Benzenocarboxylic
-Dracyl
-Carboxibenzene
-Benzenophoremical
Formula molekul
C7H6Sama ada2 atau c6H5COOH
Berat molekul
122,123 g/mol.
Penerangan fizikal
Pepejal atau dalam bentuk kristal, biasanya putih, tetapi boleh membentangkan warna kuning air jika ia menempatkan kekotoran tertentu. Kristalnya adalah skema atau jarum berbentuk.
Bau
Bau seperti badam dan sedap.
Rasa
Tidak sedap atau sedikit pahit. Had pengesanan rasa adalah 85 ppm.
Takat didih
480º F A 760 mmHg (249 ºC).
Takat lebur
252.3º F (121.5-123.5 ºC).
titik pencucuhan
250º F (121 ºC).
Sublimasi
Boleh menyahaktifkan dari 100 ºC.
Kelarutan air
3.4 g/l A 25 ºC.
Kelarutan dalam pelarut organik
- 1 g asid benzoik larut dalam jumlah yang sama dengan: 2.3 ml alkohol sejuk, 4.5 ml kloroform, 3 ml eter, 3 ml aseton, 30 ml karbon tetraklorida, 10 ml benzena, 30 ml karbon disulfida, dan 2.3 ml minyak treem.
- Ia juga larut dalam minyak yang tidak menentu dan tetap.
- Ia sedikit larut dalam minyak eter.
- Kelarutannya di heksano adalah 0.9 g/L, dalam metanol 71.5 g/l, dan dalam toluena 10.6 g/l.
Ketumpatan
1,316 g/ml pada 82.4º F, dan 1,2659 g/ml pada suhu 15 ° C.
Ketumpatan stim
4,21 (dengan hubungan udara diambil sebagai rujukan = 1)
Tekanan wap
1 mmHg pada 205º F dan 7.0 x 10-4 mmHg pada 25 ºC.
Kestabilan
Penyelesaian dengan kepekatan 0.1% dalam air stabil selama sekurang -kurangnya 8 minggu.
Penguraian
Ia terurai dengan memanaskan, memancarkan asap ekar dan menjengkelkan.
Goo
1.26 cpoise pada 130 ºC.
Haba pembakaran
3227 kJ / mol.
Haba pengewapan
534 kJ /mol pada 249 ºC.
Ph
Sekitar 4 di dalam air.
Ketegangan permukaan
31 N/M A 130 ºC.
PKA
4.19 hingga 25 ºC.
Indeks refraktif
1,504-1,5397 (ηd) pada 20 ºC.
Reaksi
- Bersentuhan dengan pangkalan (NaOH, KOH, dll.) Membentuk jualan benzoat. Sebagai contoh, jika anda bertindak balas dengan bentuk NaOH, natrium benzoat, c6H5Jalan.
- Bertindak balas dengan alkohol untuk membentuk ester. Contohnya, tindak balasnya terhadap etil alkohol berasal dari ester etil. Beberapa ester asid benzoik memenuhi fungsi sebagai plastik.
- Bertindak balas dengan fosforus pentachloride, PCL5, Untuk membentuk klorida benzoil, halida asid. Benzoil Chloride boleh bertindak balas dengan ammonium (NH3) atau amina seperti methylamine (CHO3NH2) Untuk membentuk benzamide.
- Reaksi asid benzoik dengan asid sulfurik menghasilkan sulfonasi cincin aromatik. Kumpulan berfungsi -jadi3H Menggantikan atom hidrogen dalam kedudukan sasaran cincin.
Ia boleh melayani anda: Revolusi Kimia Pertama- Ia boleh bertindak balas dengan asid nitrik, dengan penggunaan asid sulfurik sebagai pemangkin, membentuk asid meta-nitrobenzoik.
- Di hadapan pemangkin, seperti ferric chloride, FECL3, Asid benzoik bertindak balas dengan halogen. Sebagai contoh, ia bertindak balas dengan klorin untuk pembentukan asid meta-chlorobenzoic.
Pengeluaran
Beberapa kaedah pengeluaran sebatian ini:
- Sebilangan besar asid benzoik berlaku secara industri dengan mengoksidakan toluena dengan oksigen yang terdapat di udara. Proses ini dipangkin oleh petrol kobalt, pada suhu 140-160 ºC dan pada tekanan 0.2-0.3 MPa.
- Toluena boleh berklorin untuk menghasilkan benzotriklorida, yang kemudiannya dihidrolisiskan dengan asid benzoik.
- Hidrolisis benzonitril dan benzamida, dalam medium berasid atau alkali, boleh menyebabkan asid benzoik dan pangkalannya konjugasi.
- Alkohol benzil dalam pengoksidaan yang diantarkan oleh kalium permanganat, dalam medium berair, menghasilkan asid benzoik. Tindak balas berlaku oleh pemanasan atau penyulingan refluks. Setelah proses selesai, campuran ditapis untuk menghilangkan mangan dioksida, sementara supernatan disejukkan untuk mendapatkan asid benzoik.
- Sebatian benzocticloride bertindak balas dengan kalsium hidroksida, menggunakan garam besi atau besi sebagai pemangkin, pada mulanya membentuk kalsium benzoat, Ca (c (c (c (c (c6H5COO)2. Kemudian garam ini, dengan tindak balas dengan asid hidroklorik, ditukar menjadi asid benzoik.
Asid benzoik menggunakan
Industrialis
- Ia digunakan dalam pengeluaran fenol oleh decarboxylation oksidatif asid benzoik pada suhu 300-400 ºC, kerana fenol boleh digunakan dalam sintesis nilon.
- Dari situ glikol benzoat, pendahulu kimia ester diethylene glikol dan ester triethylene glikol, bahan yang digunakan sebagai plasticizer. Mungkin aplikasi plasticizers yang paling penting adalah formulasi pelekat. Beberapa ester rantai panjang digunakan untuk melembutkan plastik seperti PVC.
- Ia digunakan sebagai pengaktif pempolimeran getah. Di samping itu, ia adalah perantara dalam pembuatan resin alquidic, serta bahan tambahan untuk aplikasi dalam pemulihan minyak mentah.
- Di samping itu, ia digunakan dalam penjelasan resin, pewarna, serat, racun perosak dan sebagai agen pengubahsuaian resin poliamida untuk pengeluaran poliester. Ia digunakan untuk penyelenggaraan aroma tembakau.
Boleh melayani anda: garam binari- Ia adalah pendahulu untuk klorida benzoil, yang merupakan bahan permulaan untuk sintesis sebatian seperti benzyl benzoate, yang digunakan dalam penjelasan perisa buatan dan serangga serangga.
Ubat
- Ia adalah komponen Oint Whitfield. Salap ini terdiri daripada 6% asid benzoik dan 3% asid salisilik.
- Ia adalah ramuan tincture benzoin, digunakan sebagai menghirup antiseptik topikal dan dekongestan. Ia digunakan sebagai expectorant, analgesik dan antiseptik sehingga permulaan abad ke -20.
- Asid benzoik telah digunakan dalam terapi eksperimen pesakit dengan penyakit pengumpulan nitrogen sisa.
Pemuliharaan makanan
- Asid benzoik dan garamnya digunakan dalam pemuliharaan makanan. Kompaun mampu menghalang pertumbuhan acuan, ragi dan bakteria, melalui mekanisme yang bergantung kepada pH.
Menyusahkan
Boleh bertindak balas dengan asid askorbik (vitamin C) yang terdapat dalam beberapa minuman, menghasilkan benzena, kompaun karsinogen. Oleh sebab itu, sebatian lain sedang dicari dengan keupayaan untuk memulihara makanan yang tidak menimbulkan masalah asid benzoik.
Yang lain
- Ia digunakan dalam pembungkusan aktif, yang hadir dalam ionomeres. Dari mereka, asid benzoik dilepaskan, mampu menghalang pertumbuhan spesies genera Penicillium dan Aspergillus Dalam media mikrob.
- Ia digunakan sebagai ejen pengawet aroma jus buah dan minyak wangi.
- Asid benzoik digunakan sebagai herbisida selektif untuk mengawal rumpai dengan lebar dan rumput dalam kacang soya, timun, tembikai, kacang tanah dan tumbuhan hiasan berkayu.
Ketoksikan
- Bersentuhan dengan kulit dan mata ia dapat menghasilkan kemerahan. Dengan penyedutan boleh menyebabkan kerengsaan pernafasan dan batuk. Pengambilan sejumlah besar asid benzoik boleh menyebabkan gangguan gastrousus, dapat mencapai kerosakan hati dan buah pinggang.
- Asid benzoik dan benzoat boleh melepaskan histamin yang boleh menyebabkan reaksi alergi dan kerengsaan mata, kulit dan membran mukus.
- Ia tidak mempunyai kesan kumulatif, mutagenik atau karsinogenik, kerana ia diserap dengan cepat dalam usus, menghapuskan air kencing tanpa terkumpul di dalam badan.
- Dos maksimum yang dibenarkan mengikut WHO 5 mg/kg berat badan/hari, kira -kira 300 mg/hari. Dos ketoksikan akut pada manusia: 500 mg/kg.
Rujukan
- Asid benzoik. Pulih dari buku kimia.com
- Asid benzoik. Pulih dari pubchem.NCBI.NLM.NIH.Gov
- Asid benzoik. Diambil dari.Wikipedia.org

