Asid klorik (HCLO3)
- 2310
- 611
- Erick Krajcik
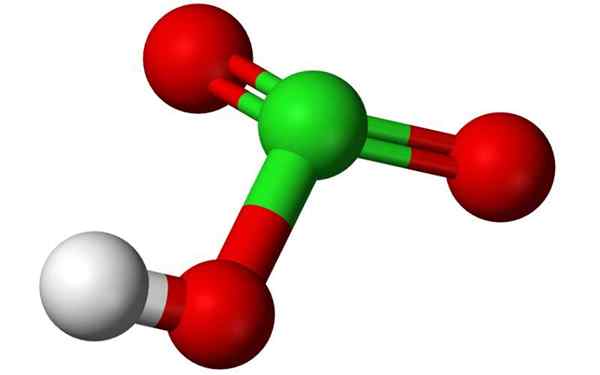
 Struktur kimia asid klorik dalam model belon 3D. Sumber: Benjah-bmm27, Wikimedia Commons
Struktur kimia asid klorik dalam model belon 3D. Sumber: Benjah-bmm27, Wikimedia Commons Apakah asid klorik?
Dia Asid klorik Ia adalah sebatian formula HCLO bukan organik3, oxacid klorin dan prekursor formal garam klorat. Ia adalah asid kuat yang mampu menderma hidrogen kepada penerima atau asas tronsted.
Kompaun diperolehi dengan barium chlorate (barite chlorate) dengan asid sulfurik untuk menghasilkan barium sulfat, air tidak larut mengikut reaksi berikut:
BA (clo3)2 + H2SW4 → 2Hclo3 + Baso4
Satu lagi kaedah mendapatkan ialah pemanasan asid hypochlorous untuk mendapatkan asid kloro dan hidrogen klorida mengikut reaksi:
3Hclo → HClo3 + 2HCl
Asid klorik (HClo3) adalah oksidan yang kuat memandangkan ia mampu mengurangkan keadaan pengoksidaan +3, +1 dan -1. Ia digunakan untuk pembuatan garam klorat.
Ia terurai ke dalam kepekatan lebih besar daripada 30%. Ia juga pecah apabila dipanaskan, jadi ia mesti disimpan sejuk sepanjang masa, dan semua balang kaca yang digunakan untuk mengendalikan mesti disejukkan sebelumnya.
Sifat fizikal dan kimia
- Asid klorik hanya wujud dalam larutan. Ia adalah cecair tanpa warna tanpa aroma ciri.
- Kompaun mempunyai berat molekul 84,459 g/mol dan ketumpatan 1 g/ml pada 25 ° C.
- Ia mempunyai titik mendidih lebih besar daripada 100 ° C dan kelarutan air 40 g setiap 100 ml pelarut ini pada 25 ° C.
- Asid klorik akan mempercepatkan pembakaran bahan mudah terbakar dan dapat menghidupkan majoriti yang bersentuhan. Kompaunnya menghakis untuk logam dan tisu.
Boleh melayani anda: coprecipitationSendiri-reaktif
- Kepekatan asid klorik melebihi 40% terurai.
- Penyelesaian sulfida antimoni dan pekat asid klorik bertindak balas dengan pendirian.
- Penyelesaian sulfida arsenik dan pekat asid klorik bertindak balas dengan incandescence.
- Bertindak balas dengan semangat, walaupun meletup dengan sulfida logam lain, iaitu, tembaga sulfida.
- Bersentuhan dengan bahan -bahan teroksida, termasuk ammonia, reaksi boleh menjadi sangat ganas.
- Kertas penapis menyala selepas menenggelamkannya dalam asid hidroklorik.
- Ledakan telah direkodkan oleh campuran penyelesaian asid klorik dengan logam seperti antimoni, bismut dan besi. Ini disebabkan oleh pembentukan sebatian letupan, termasuk hidrogen.
Kereaktifan dan bahaya
Asid klorik adalah sebatian yang tidak stabil. Menjadi asid yang kuat, ia sangat berbahaya dalam hal hubungan kulit (ia adalah menghakis dan menjengkelkan), hubungan mata (menjengkelkan) dan dalam hal pengambilan. Juga sangat berbahaya sekiranya penyedutan.
Pendedahan yang teruk boleh menyebabkan kerosakan paru -paru, lemas, kehilangan pengetahuan atau kematian. Pendedahan berpanjangan boleh menyebabkan luka kulit dan ulserasi.
Penyedutan pendedahan boleh menyebabkan kerengsaan pernafasan. Keradangan mata dicirikan oleh kemerahan, pengairan dan gatal -gatal. Keradangan kulit dicirikan oleh gatal -gatal, mengelupas, kemerahan dan kadang -kadang, pembentukan ampul.
Bahan itu beracun kepada buah pinggang, paru -paru dan membran mukus. Pendedahan berulang atau berpanjangan kepada bahan boleh menyebabkan kerosakan pada organ -organ ini.
Sekiranya hubungan mata, anda mesti mengesahkan sama ada kanta lekap digunakan dan mengeluarkannya dengan segera. Mata harus dibilas dengan air mengalir selama sekurang -kurangnya 15 minit, menjaga kelopak mata terbuka. Air sejuk boleh digunakan. Tidak ada lembaran mata yang harus digunakan.
Boleh melayani anda: Acetonitrile (C2H3N)Sekiranya bahan kimia bersentuhan dengan pakaian, simpannya secepat mungkin, melindungi tangan dan badannya sendiri. Letakkan mangsa di bawah mandi keselamatan.
Sekiranya bahan kimia berkumpul di kulit yang terdedah kepada mangsa, seperti tangan, kulit yang tercemar dengan air yang mengalir dan sabun yang tidak abrasive dibasuh dengan lembut dan berhati -hati.
Anda juga boleh meneutralkan asid dengan natrium hidroksida yang dicairkan atau dengan asas yang lemah seperti natrium bikarbonat. Sekiranya kerengsaan berterusan, dapatkan perhatian perubatan. Basuh pakaian yang tercemar sebelum menggunakannya lagi.
Sekiranya sentuhan kulit serius, ia harus dibasuh dengan sabun disinfektan dan menutup kulit yang tercemar dengan krim antibakteria.
Sekiranya penyedutan, mangsa harus dibenarkan berdiri di kawasan pengudaraan yang baik. Sekiranya penyedutan itu serius, mangsa mesti dipindahkan ke kawasan yang selamat secepat mungkin.
Pakaian ketat longgar, seperti leher baju, tali pinggang atau tali leher. Sekiranya mangsa sukar bernafas, oksigen mesti diberikan. Sekiranya mangsa tidak bernafas, resusitasi mulut dibuat.
Perlu dipertimbangkan bahawa ia boleh berbahaya bagi orang yang memberikan bantuan untuk memberi mulut ke mulut ke mulut, apabila bahan yang dihirupnya beracun, berjangkit atau menghakis.
Sekiranya berlaku pengambilan, ia tidak mendorong muntah. Pakaian ketat, seperti leher baju, tali pinggang atau ikatan. Sekiranya mangsa tidak bernafas, jadikan mulut mulut. Dalam semua kes, perhatian perubatan segera harus dicari.
Aplikasi
Asid klorik terutamanya digunakan untuk pembentukan garam klorat, seperti natrium, kalsium, magnesium, strontium, plumbum, tembaga dan perak kloro, serta protocloreate dan merkuri percelore disediakan menggunakan asid klorik sebagai reagen sebagai reagen sebagai reagen sebagai reagen sebagai reagen sebagai reagen sebagai reagen sebagai reagen sebagai reagen sebagai reagen.
Boleh melayani anda: Aktiviti enzimatik: Unit, Pengukuran, Peraturan dan FaktorPrekursor stabil klorin dioksida, digunakan dalam pengeluaran elektrokimia ammonium kemurnian tinggi.
Pengeluaran utama asid klorik bermula semasa revolusi perindustrian di Eropah dan digunakan untuk mengeluarkan vinil klorida untuk paip PVC.
Penggunaan lain untuk asid dalam banyak aplikasi skala yang lebih kecil, termasuk pembersihan domestik, pengeluaran gelatin dan bahan tambahan makanan lain, decalcification dan pemprosesan kulit.
Rujukan
- Asid klorik (s.F.). Pulih dari Weebly.com.
- Asid klorik (s.F.). Pulih dari buku kimia.com.

