Asid kuat
- 3073
- 726
- Ismael Turner
 Asid yang kuat adalah asid yang dipisahkan sepenuhnya dalam tekanan dan penyelesaian suhu tetap
Asid yang kuat adalah asid yang dipisahkan sepenuhnya dalam tekanan dan penyelesaian suhu tetap Apa itu asid yang kuat?
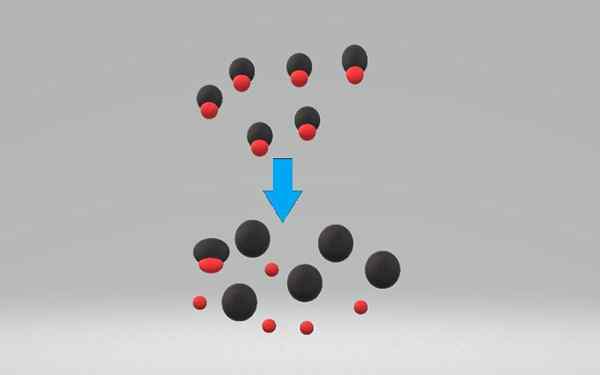
A asid kuat Ia adalah apa -apa kompaun yang mampu melepaskan dan tidak dapat dipulihkan proton atau ion hidrogen, h+. Menjadi begitu reaktif, sebilangan besar spesies terpaksa menerima h ini+, seperti air, campurannya menjadi berpotensi berbahaya dengan hubungan fizikal yang mudah.
Asid menyumbangkan proton ke air, yang berfungsi sebagai asas untuk membentuk ion hidrium, h3Sama ada+. Kepekatan ion hidronium dalam larutan asid kuat adalah sama dengan kepekatan asid ([h3Sama ada+] = [Hac]).
Semakin tinggi kepekatan asid (lemah atau kuat), ia mesti lebih berhati -hati dalam manipulasi. Itulah sebabnya botol asid hidroklorik, nitrik atau sulfurik menunjukkan pictogram tangan yang disakiti oleh harta yang menghakis penurunan asid yang jatuh di atasnya.
Asid kuat adalah bahan yang mesti dimanipulasi dengan kesedaran sepenuhnya mengenai kemungkinan mereka. Bekerja dengan mereka dengan teliti dapat memanfaatkan sifat mereka untuk kegunaan berganda, menjadi salah satu sintesis yang paling biasa atau cara pensampelan.
Sifat asid yang kuat
Penyisihan
Asid yang kuat memisahkan atau ioniza dalam 100% dalam larutan akueus, menerima beberapa elektron. Pemisahan asid boleh skema dengan persamaan kimia berikut:
Hac +h₂o => a- + H3Sama ada+
Di mana asid kuat, dan- Pangkalan konjugasi anda.
Pengionan asid kuat adalah proses yang biasanya tidak dapat dipulihkan. Dalam asid lemah, sebaliknya, pengionan boleh diterbalikkan. Persamaan menunjukkan bahawa H₂o adalah yang menerima proton, bagaimanapun, alkohol dan pelarut lain juga boleh melakukannya.
Boleh melayani anda: bateri keringKecenderungan untuk menerima proton berbeza dari bahan ke bahan, dan oleh itu, daya asid HAC tidak sama dalam semua pelarut.
Ph
PH asid kuat sangat rendah, antara 0 dan 1 unit pH. Contohnya, penyelesaian HCL 0.1 m mempunyai pH 1.
Ini dapat ditunjukkan dengan menggunakan formula
ph = - log [h+]
Anda boleh mengira pH penyelesaian HCl 0.1 m, kemudian memohon
ph = -log (0.1)
Mendapatkan pH 1 untuk penyelesaian HCl 0.1 m.
PKA
Kekuatan asid berkaitan dengan PKA mereka. Ion hidrium (h3Sama ada+), sebagai contoh, mempunyai PKA -1.74. Umumnya, asid kuat mempunyai pKA dengan nilai yang lebih negatif daripada -1.74, dan oleh itu, lebih banyak asid daripada H sendiri3Sama ada+.
PKA menyatakan dengan cara tertentu trend asid untuk memisahkan. Semakin rendah nilainya, yang lebih kuat dan paling agresif akan menjadi asid. Atas sebab ini, adalah mudah untuk menyatakan kekuatan relatif asid melalui nilai PKAnya.
Kakisan
Secara umum, asid kuat diklasifikasikan sebagai menghakis. Walau bagaimanapun, terdapat pengecualian untuk andaian ini.
Sebagai contoh, asid fluorhorhoric adalah asid yang lemah, dan bagaimanapun, ia sangat menghakis dan mampu membubarkan kaca. Kerana ini anda perlu memanipulasi dalam botol plastik dan suhu rendah.
Sebaliknya, asid kekuatan besar seperti asid super karbon, yang walaupun berjuta -juta kali lebih kuat daripada asid sulfurik tidak mengakis.
Faktor yang mempengaruhi asid yang kuat
Elektronegativiti asas konjugasi
Sebagai anjakan yang betul berlaku dalam tempoh jadual berkala, negatif unsur -unsur yang membentuk asas konjugasi meningkat.
Boleh melayani anda: isotherms penjerapan: konsep, jenis, contohPemerhatian Tempoh 3 Jadual Berkala menunjukkan, sebagai contoh, klorin lebih banyak elektronegatif daripada sulfur dan pada gilirannya, sulfur lebih elektronegatif daripada fosforus.
Ini bersetuju dengan fakta bahawa asid hidroklorik lebih kuat daripada asid sulfurik, dan yang terakhir lebih kuat daripada asid fosforik.
Dengan meningkatkan elektronegativiti asas konjugasi asid, ia meningkatkan kestabilan asas, dan oleh itu mengurangkan kecenderungannya untuk berkumpul semula dengan hidrogen untuk menjana semula asid.
Walau bagaimanapun, faktor lain harus dipertimbangkan, kerana ini tidak tegas sahaja.
Radio asas konjugasi
Daya asid juga bergantung pada jejari asas konjugasi. Pemerhatian Kumpulan VIIA Jadual Berkala (Halogenos) menunjukkan bahawa radio atom unsur -unsur yang membentuk kumpulan menyimpan hubungan berikut: i> br> cl> f.
Begitu juga, asid yang membentuk menyimpan urutan yang sama berkurangan daya asid:
Hai> hbr> hcl> hf
Kesimpulannya, dengan meningkatkan jejari atom unsur -unsur kumpulan yang sama dalam jadual berkala, daya asid yang membentuk peningkatan dalam erti kata yang sama.
Ini dijelaskan dalam kelemahan pautan H-AC oleh saiz orbital atom yang tidak sama rata.
Bilangan atom oksigen
Daya asid dalam siri oxacids bergantung kepada bilangan atom oksigen yang mempunyai asas konjugasi.
Boleh melayani anda: 10 contoh pautan kovalen bukan polarMolekul yang mempunyai bilangan atom oksigen terbesar membentuk spesies dengan daya berasid yang lebih besar. Sebagai contoh, asid nitrik (HNO3) Ia adalah asid yang lebih kuat daripada asid nitrous (HNO2).
Sebaliknya, asid percloric (HCLO4) adalah asid yang lebih kuat daripada asid klorik (HCLO3). Dan akhirnya, asid hipoklorus (HCLO) adalah asid kekuatan yang lebih rendah dalam siri ini.
Contoh asid kuat
- Asid yodhydric (HI)
- Asid Bromhydric (HBR)
- Asid perchloric (HCLO4)
- Asid hidroklorik (HCL)
- Asid sulfurik (h2SW4)
- Asid p-toluenosulfonic (CHO3C6H4SW3H)
- Asid nitrik (HNO3)
- Asid bromik (HBRO3)
- Asid yodium (hio3)
- Asid klorik (HCLO3)
- Asid nitrous (HNO2)
- Asid fluoroantimonic (H [SBF6]
- Asid fluorosulfonic (FSO3H)
- Asid trifluoromethanosulfonic (CF3SW3H)
- Asid Magic (FSO3HSBF5)
Rujukan
- Sifat yang menentukan kekuatan asid. Pulih dari shmoop.com
- Helmestine, Anne Marie. Definisi dan contoh asid yang kuat. Pulih dari pemikiran.com

