Asid píchric apa, struktur, sintesis, sifat
- 4640
- 143
- Ms. Santos Fritsch
Dia Asid píchric Ia adalah sebatian kimia organik yang sangat nitrado yang namanya IUPAC adalah 2,4,6-trinitrofenol. Formula molekulnya adalah c6H2(Tidak2)3Oh. Ia adalah fenol yang sangat berasid, dan boleh didapati sebagai natrium picrate, ammonium atau kalium; iaitu, dalam bentuk ioniknya c6H2(Tidak2)3DI ATAS.
Ia adalah pepejal rasa yang kuat pahit, dan dari sana memperoleh namanya, dari perkataan Yunani 'prikos', yang bermaksud pahit. Ia dijumpai sebagai kristal kuning basah. Dehidrasi atau dehidrasi berbahaya, kerana ia meningkatkan sifat yang tidak stabil yang menjadikannya letupan.
Asid píchric digunakan sebagai asas untuk sintesis pewarna nada kuning kekal. Sesetengah ahli patologi dan penyelidik menggunakannya dalam penetapan atau pewarnaan bahagian tisu dan proses imunohistokimia lain.
Ia sangat berguna dalam pembangunan produk farmaseutikal. Di samping itu, ia digunakan dalam penjelasan perlawanan atau perlawanan dan bahan letupan. Ia juga digunakan untuk merakam logam, membuat kaca berwarna, dan dalam penentuan warna parameter biologi seperti kreatinin.
Struktur
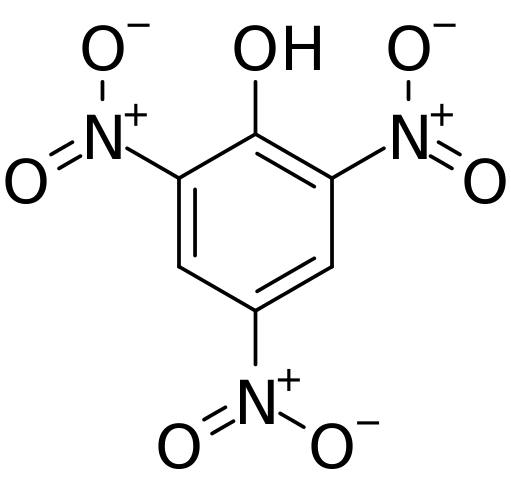
 Struktur dan beban rasmi dalam asid pychoric. Sumber: CVF-PS [Domain Awam]
Struktur dan beban rasmi dalam asid pychoric. Sumber: CVF-PS [Domain Awam] Di bahagian atas semua ikatan dan struktur dengan sendirinya molekul asid píchric ditunjukkan dengan lebih terperinci. Ia terdiri daripada fenol dengan tiga substituen nitro.
Dapat dilihat bahawa dalam kumpulan tidak2 Atom nitrogen mempunyai beban separa positif, dan oleh itu permintaan untuk ketumpatan elektronik dari persekitarannya. Tetapi, cincin aromatik juga menarik elektron ke arah dirinya sendiri, dan sebelum ketiga tidak2 akhirnya memberikan sebahagian daripada ketumpatan elektroniknya sendiri.
Akibatnya, oksigen kumpulan OH cenderung lebih banyak untuk berkongsi salah satu rakan elektronik bebas untuk membekalkan kekurangan elektronik yang dialami oleh cincin; Dan dengan berbuat demikian, pautan c = o terbentuk+-H. Beban separa positif dalam oksigen melemahkan ikatan O-H, dan peningkatan keasidan; iaitu, ia akan dikeluarkan sebagai ion hidrogen, h+.
Fenol asid
Oleh sebab itu, sebatian ini adalah asid yang sangat kuat (dan reagen), bahkan lebih daripada asid asetik itu sendiri. Walau bagaimanapun, kompaun itu benar -benar fenol yang keasidan melampaui fenol lain; kerana, seperti yang baru disebutkan, substituen tidak2.
Boleh melayani anda: proses termodinamikOleh itu, kerana ia adalah fenol, kumpulan OH mempunyai keutamaan dan mengarahkan penghitungan dalam struktur. Ketiga -tiga tidak2 Mereka terletak di karbon 2, 4 dan 6 cincin aromatik berkenaan dengan oh. Dari sini memperoleh tatanama IUPAC untuk sebatian ini: 2,4,6-trinitrofenol (TNP).
Sekiranya kumpulan tidak2, Atau jika terdapat bilangan yang lebih kecil di dalam cincin, pautan O-H akan lemah, dan oleh itu sebatian itu akan kurang keasidan.
Struktur kristal
Molekul asid pycric diperintahkan sedemikian rupa sehingga mereka memihak kepada interaksi intermolecular mereka; sama ada untuk pembentukan jambatan hidrogen antara kumpulan OH dan tidak2, Pasukan Dipolo-dipolo, atau penolakan elektrostatik antara kawasan elektron miskin.
Boleh dijangkakan bahawa kumpulan tidak2 Mereka menolak satu sama lain dan bimbingan ke arah cincin aromatik jiran. Begitu juga, cincin tidak dapat menyelaraskan satu di atas satu sama lain kerana peningkatan penolakan elektrostatik.
Hasil daripada semua interaksi ini, asid píchric berjaya membentuk rangkaian tiga dimensi yang mentakrifkan kristal; sel kesatuan yang sepadan dengan sistem kristal jenis ortorrombik.
Sintesis
Pada mulanya ia disintesis dari sebatian semula jadi seperti derivatif tanduk haiwan, resin semula jadi, antara lain. Sehingga tahun 1841, fenol telah digunakan sebagai pendahulu kepada asid picric, mengikuti beberapa laluan atau melalui beberapa prosedur kimia.
Seperti yang telah dikatakan, ia adalah salah satu fenol yang paling berasid. Untuk mensintesisnya, pertama kali diperlukan bahawa fenol mengalami proses sulfonasi, diikuti dengan prosedur nitrasi.
Sulfonasi fenol anhydrous dilakukan ketika merawat fenol dengan asid sulfurik asap, penggantian elektrofilik aromatik yang berlaku oleh h oleh kumpulan sulfonat, jadi3H, dalam kedudukan -orto dan -para berkenaan dengan kumpulan OH.
Produk ini, asid 2,4-pynoldisulfonic, proses nitrasi dijalankan, merawatnya dengan asid nitrik pekat. Dengan berbuat demikian, kedua -dua kumpulan itu3H digantikan oleh kumpulan nitro, tidak2, Dan yang ketiga memasuki kedudukan nitro yang lain. Persamaan kimia berikut menggambarkan ini:
Boleh melayani anda: Bahan elastik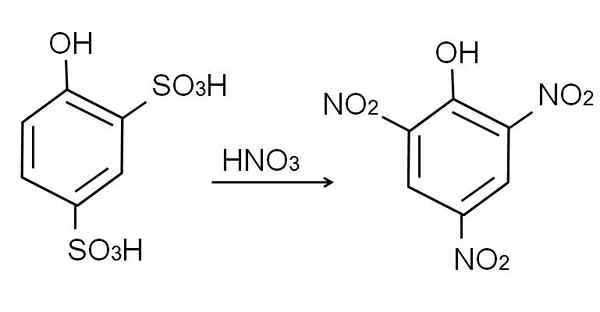 Nitrasi asid 2,4-phenoldisulfonic. Sumber: Gabriel Bolívar.
Nitrasi asid 2,4-phenoldisulfonic. Sumber: Gabriel Bolívar. Nitrasi langsung fenol
Proses nitrasi fenol tidak dapat dijalankan secara langsung, kerana sasaran berat molekul yang tinggi dihasilkan. Kaedah sintesis ini memerlukan kawalan suhu yang sangat berhati -hati kerana ia sangat eksotermik:
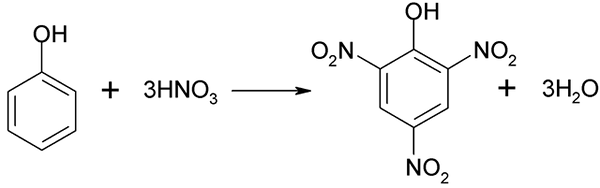 Nitrasi langsung fenol. Sumber: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Nitrasi langsung fenol. Sumber: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Asid píchric boleh diperolehi semasa melaksanakan proses nitrasi langsung 2.4-dinitrofenol, dengan asid nitrik.
Satu lagi bentuk sintesis ialah merawat benzena dengan asid nitrik dan nitrat merkurik.
Sifat fizikal dan kimia
Berat molekul
229.104 g/mol.
Penampilan fizikal
Jisim kuning kristal basah.
Bau
Ia adalah tandas.
Rasa
Ia sangat pahit.
Takat lebur
122.5 ° C.
Takat didih
300 ° C. Tetapi, ketika mencair, ia meletup.
Ketumpatan
1.77 g/ml.
Kelarutan
Ia adalah sebatian larut air yang sederhana. Ini kerana kumpulan OH anda dan tidak2 Mereka boleh berinteraksi dengan molekul air oleh jambatan hidrogen; Walaupun cincin aromatik adalah hidrofobik, dan itulah sebabnya ia merosakkan kelarutannya.
Korosiviti
Asid pycric menghakis secara umum untuk logam, kecuali timah dan aluminium.
PKA
0.38. Ia adalah asid organik yang kuat.
Ketidakstabilan
Asid píchric dicirikan dengan memiliki sifat yang tidak stabil. Ia merupakan risiko kepada alam sekitar, ia tidak stabil, letupan dan toksik.
Ia mesti disimpan dengan baik untuk mengelakkan dehidrasi, kerana asid picric sangat meletup jika dibenarkan kering. Anda mesti berhati -hati dengan bentuk anhidratnya, kerana ia sangat sensitif terhadap geseran, pukulan dan panas.
Asid pychral harus disimpan di tapak pengudaraan, segar, jauh dari bahan yang teroksida. Ia menjengkelkan untuk dihubungkan dengan kulit dan membran mukus, ia tidak boleh ditelan, dan ia adalah toksik kepada badan.
Aplikasi
Asid píchric telah digunakan secara meluas di kawasan penyelidikan, dalam bidang kimia, dalam industri dan dalam bidang ketenteraan.
Penyiasatan
Apabila digunakan sebagai sel dan tisu, ia meningkatkan hasil warna mereka dengan pewarna asid. Ia berlaku dengan kaedah pewarnaan trikromik. Setelah menetapkan kain dengan formalin, penetapan baru dengan asid píchric disyorkan.
Boleh melayani anda: tekan penapis: ciri, bahagian, bagaimana ia berfungsi, kegunaanDengan cara ini, warna tisu yang sengit dan sangat terang dijamin. Hasil yang baik diperoleh dengan pewarna asas. Walau bagaimanapun, langkah berjaga -jaga mesti.
Kimia organik
-Dalam kimia organik ia digunakan sebagai picrat alkali untuk membuat pengenalan dan analisis pelbagai bahan.
-Digunakan dalam kimia analisis logam.
-Di makmal klinikal ia digunakan dalam menentukan tahap serum dan kencing kreatinin.
-Ia juga telah digunakan dalam beberapa reagen yang digunakan untuk analisis tahap glukosa.
Dalam industri
-Di peringkat industri fotografi, asid píchric telah digunakan sebagai pemekaan dalam emulsi fotografi. Telah menjadi sebahagian daripada penjelasan produk seperti racun perosak, racun serangga yang kuat, antara lain.
-Asid píchric digunakan untuk mensintesis sebatian kimia pertengahan lain seperti chloropicrine dan asid picramical, sebagai contoh. Dari sebatian ini beberapa ubat dan pewarna untuk industri kulit telah dibangunkan.
-Asid píchric digunakan dalam rawatan luka bakar, seperti keadaan antiseptik dan lain -lain, sebelum ketoksikannya dibuktikan.
-Komponen penting dengan sifat letupannya dalam penjelasan perlawanan dan bateri.
Permohonan ketenteraan
-Kerana letupan tinggi asid píchric, ia telah digunakan dalam loji peluru senjata tentera.
-Asid píchric ditekan dan diletakkan dalam projektil artileri, pam dan lombong telah digunakan.
-Garam ammonium asid pycric telah digunakan sebagai bahan letupan, sangat kuat tetapi kurang kestabilan daripada TNT. Untuk seketika ia digunakan sebagai komponen bahan api roket.
Ketoksikan
Telah terbukti bahawa ia sangat toksik kepada organisma manusia dan secara umum untuk semua makhluk hidup.
Adalah disyorkan untuk mengelakkan penyedutan dan pengambilannya, kerana mempunyai ketoksikan lisan akut. Ia juga menyebabkan mutasi dalam mikroorganisma. Ia memberikan kesan toksik pada hidupan liar, dalam mamalia dan secara umum di alam sekitar.
Rujukan
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Universiti Purdue. (2004). Letupan asid picric. Diperolehi daripada: Chemed.Chem.Purdue.Edu

