Asid sulfur
- 943
- 247
- Kerry Schmitt
 Asid sulfur adalah asid mineral yang berlaku apabila sulfur dioksida larut dalam air
Asid sulfur adalah asid mineral yang berlaku apabila sulfur dioksida larut dalam air Apakah asid sulfur?
Dia Asid sulfur Ia adalah oxácido yang terbentuk ketika sulfur dioksida, jadi2, larut dalam air. Ia adalah asid anorganik yang lemah dan tidak stabil, yang tidak dapat dikesan dalam larutan, kerana reaksi pembentukannya boleh diterbalikkan dan asid terurai dengan cepat dalam reagen yang menghasilkannya (begitu juga2 dan h₂o).
Ia adalah cecair yang tidak berwarna, dengan bau sulfur yang kuat, tidak stabil, dan digunakan dalam pelbagai bidang perindustrian, seperti bahan berwarna klorin, untuk sintesis produk ubat dan kimia, untuk pembuatan kertas, atau untuk memperbaiki derivatif petroleum.
Molekul asid sulfur pada masa ini hanya dikesan dalam fasa gas. Pangkalan konjugasi asid ini adalah anion biasa di bawah bentuk sulfit dan bisulfite.
Spektrum penyelesaian So Raman2 Ia hanya menunjukkan tanda -tanda kerana molekul begitu2 dan ion bisulfite, HSO3-, Selaras dengan keseimbangan berikut:
SW2 + H₂o hso3- + H+
Ini menunjukkan bahawa oleh spektrum Raman tidak mungkin.
Apabila terdedah kepada atmosfera, ia berubah menjadi asid sulfurik dengan cepat. Asid sulfur dikurangkan kepada hidrogen sulfida kerana tindakan asid sulfurik yang dicairkan dan zink.
Percubaan untuk menumpukan penyelesaian SO2 Dengan penyejatan air untuk mendapatkan asid sulfur bebas air, ia tidak menghasilkan hasil, kerana asid terurai dengan cepat (melabur tindak balas pembentukan), jadi asid tidak dapat dilindungi.
Struktur Asid sulfur
 Struktur kimia asid sulfur
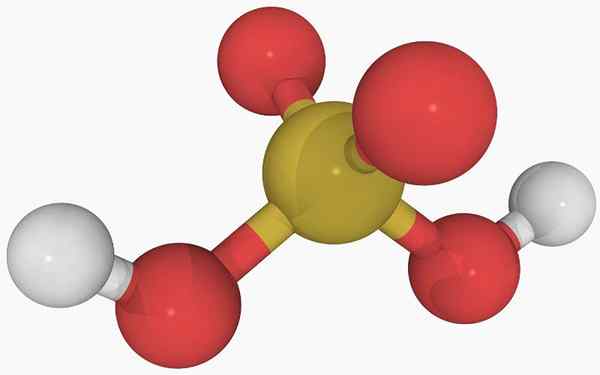
Struktur kimia asid sulfur Dalam imej utama struktur molekul terpencil asid sulfur dalam keadaan gas dapat dilihat. Lingkaran kuning di tengah sepadan dengan atom sulfur, merah ke atom oksigen, dan putih ke hidrogen.
Boleh melayani anda: diasstreomersGeometri molekulnya di sekitar atom S adalah piramid trigonal, dengan atom atau menggambar pangkalan.
Kemudian, dalam keadaan gas, molekul H2SW3 Mereka boleh dianggap sebagai piramid trigonal mikroskopik yang terapung di udara, dengan mengandaikan bahawa mereka cukup stabil untuk bertahan beberapa waktu tanpa bertindak balas.
Strukturnya menjadikannya jelas di mana dua hidrogen berasid berasal dari: dari kumpulan hidroksil yang dikaitkan dengan sulfur, ho-oh-oh. Oleh itu, untuk kompaun ini, tidak betul untuk mengandaikan bahawa salah satu proton asid, h+, dibebaskan dari atom sulfur, H-SO2(Oh).
Kedua -dua kumpulan OH membenarkan asid sulfur untuk berinteraksi menggunakan jambatan hidrogen, dan juga oksigen ikatan s = o adalah penerima hidrogen, yang menjadikan H2SW3 kedua -duanya dalam penderma yang baik dan penerima jambatan ini.
Menurut perkara di atas, h2SW3 Saya sepatutnya dapat mengekang cecair, seperti asid sulfurik, h2SW4. Walaupun begitu, itu bukan bagaimana ia berlaku.
Sifat fizikal dan kimia Asid sulfur
Formula molekul
H2SW3
Berat molekul
82.073 g/mol.
Penampilan fizikal
Ia adalah cecair tanpa warna, dengan bau sulfur pedas.
Ketumpatan
1.03 g/ml.
Ketumpatan stim
2.3 (berhubung dengan udara yang diambil sebagai 1)
Korosiviti
Ia menghakis logam dan tisu.
Kelarutan air
Boleh didapati.
Kepekaan
Ia sensitif udara.
Kestabilan
Stabil, tetapi tidak serasi dengan pangkalan yang kuat.
Pemalar keasidan (ka)
1.54 x 10-2
PKA
1.81
Ph
1.5 pada skala pH.
titik pencucuhan
Tidak mudah terbakar.
Penguraian
Apabila dipanaskan, asid sulfur boleh dipecahkan, memancarkan asap toksik sulfur oksida.
Boleh melayani anda: Kromium hidroksida: struktur, sifat, sintesis, kegunaanNomenclature
Sulfur mempunyai valensi berikut: ± 2, +4 dan +6. Dari formula h2SW3, Ia boleh dikira nombor valensi atau pengoksidaan yang mempunyai sulfur di sebatian. Untuk melakukan ini, sudah cukup untuk menyelesaikan jumlah algebra:
2 (+1) + 1v + 3 (-2) = 0
Kerana ia adalah sebatian neutral, jumlah beban atom yang membentuknya mestilah 0. Membersihkan v untuk persamaan sebelumnya, anda mempunyai:
V = (6-2)/1
Oleh itu, V sama dengan +4. Ia. Atas sebab ini, ke H2SW3 Ia dikenali sebagai asid sulfurmenanggung.
Satu lagi cara yang lebih cepat untuk menentukan Valencia ini, membandingkan H2SW3 dengan h2SW4.
Dalam h2SW4 Sulfur mempunyai Valencia +6, jadi jika satu atau, Valencia turun ke +4, dan jika satu lagi dikeluarkan, Valencia turun ke +2 (yang akan berlaku untuk asid HiccupSulfurmenanggung, H2SW2).
Walaupun kurang dikenali, kepada H2SW3 Ia juga boleh dipanggil asid trioxosulfurik (iv), mengikut nomenklatur stok.
Pembentukan asid sulfur
Asid sulfur terbentuk kerana gabungan sulfur dioksida, produk aktiviti kilang -kilang besar, dengan air atmosfera.
Atas sebab ini, ia dianggap sebagai produk pertengahan hujan asid, menyebabkan kerosakan besar terhadap pertanian dan persekitaran.
Sintesis
Secara teknikal, sulfur dibentuk untuk membentuk sulfur dioksida. Kemudian, ia larut dalam air untuk membentuk asid sulfur. Walau bagaimanapun, tindak balasnya boleh diterbalikkan dan asid cepat pecah di reaktan.
Ini adalah penjelasan mengapa asid sulfur tidak dijumpai dalam larutan akueus (seperti yang telah disebutkan dalam bahagian struktur kimianya).
Boleh melayani anda: Undang-undang bir-lambeAplikasi
Umumnya, penggunaan dan aplikasi asid sulfur, kerana kehadirannya tidak dapat dikesan, merujuk kepada penggunaan dan aplikasi sulfur dioksida dan asas dan garam asid.
Dalam kayu
Dalam proses sulfit, pulpa kayu dalam bentuk gentian selulosa yang hampir murni berlaku. Beberapa garam asid sulfur digunakan untuk pengekstrakan lignin dari serpihan kayu, menggunakan bekas tekanan tinggi yang disebut pencerna.
Ejen Disinfectant
Asid sulfur digunakan sebagai pembasmi kuman.
Peluntur
Ia juga digunakan sebagai pemutihan lembut, terutamanya untuk bahan sensitif klorin. Di samping itu, ia digunakan sebagai peluntur pergigian dan aditif makanan.
Kosmetik
Ini adalah ramuan dari pelbagai kosmetik untuk penjagaan kulit dan digunakan sebagai elemen racun perosak dalam penghapusan tikus. Menghilangkan noda yang disebabkan oleh wain atau buah -buahan pada kain yang berbeza.
Antiseptik
Ia berfungsi sebagai antiseptik, berkesan untuk mengelakkan jangkitan kulit. Dalam beberapa saat, ia digunakan dalam fumigations untuk membasmi kapal, barang -barang mangsa wabak, dll.
Ejen pengawet
Asid sulfur digunakan sebagai pengawet buah -buahan dan sayur -sayuran dan untuk mengelakkan penapaian minuman seperti wain dan bir, menjadi unsur antioksidan, antibakteria dan fungisida.
Produk kimia
Asid sulfur digunakan dalam sintesis ubat -ubatan dan bahan kimia, dalam penjelasan wain dan bir, dalam penghalusan produk yang diperolehi minyak, dan sebagai reagen analisis.
Rujukan
- Nomenclature asid. Pulih dari 2.Kimia.Gatech.Edu
- Calvo Flores, F. G. Perumusan kimia bukan organik. Ugr pulih.adalah

