Konfigurasi elektronik luaran
- 753
- 103
- Donnie Ryan
 Orbital elektronik. Sumber: Patricia.FIDI, Wikimedia Commons
Orbital elektronik. Sumber: Patricia.FIDI, Wikimedia Commons Apakah konfigurasi elektronik luaran?
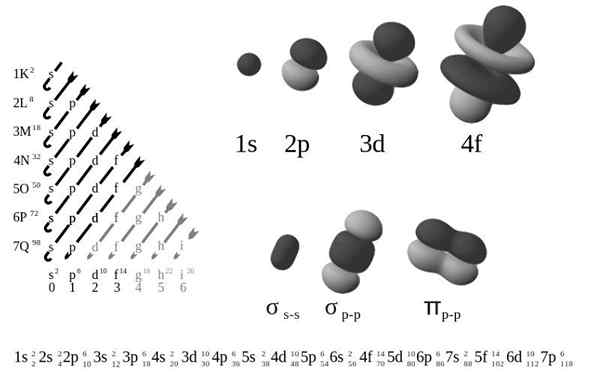
The Konfigurasi elektronik luaran, Juga dipanggil struktur elektronik, ia adalah susunan elektron pada tahap dan sub -level tenaga di sekitar nukleus atom. Tahap dari 1 hingga 7, dan sub -level adalah s, p, d dan f f dan f.
Menurut model atom lama Bohr, elektron menduduki beberapa tahap di orbit di sekitar nukleus, lapisan pertama yang paling dekat dengan nukleus, k, ke lapisan ketujuh, q, yang paling jauh.
Dari segi model mekanikal kuantum yang lebih halus, lapisan K-Q dibahagikan kepada satu set orbital, masing-masing boleh diduduki oleh tidak lebih dari beberapa elektron.
Biasanya, konfigurasi elektronik digunakan untuk menggambarkan orbital atom dalam keadaan asasnya, tetapi ia juga boleh digunakan untuk mewakili atom yang telah diionisasi dalam kation atau anion, mengimbangi kehilangan atau keuntungan elektron di orbital masing -masing.
Banyak sifat fizikal dan kimia unsur -unsur boleh dikaitkan dengan konfigurasi elektronik mereka yang unik. Elektron valencia, elektron di lapisan paling luar, adalah faktor penentu bagi kimia unik elemen.
Konsep asas konfigurasi elektronik
Sebelum menyerahkan elektron atom ke orbital, seseorang mesti akrab dengan konsep asas konfigurasi elektronik. Setiap elemen jadual berkala terdiri daripada atom, yang terdiri daripada proton, neutron dan elektron.
Elektron mempamerkan beban negatif dan berada di sekitar nukleus atom dalam orbital elektron, yang ditakrifkan sebagai jumlah ruang di mana elektron dapat dijumpai dalam kebarangkalian 95%.
Empat jenis orbital (s, p, d, dan f) mempunyai cara yang berbeza, dan orbital boleh mengandungi maksimum dua elektron. Orbitals P, D dan F mempunyai sub -level yang berbeza, jadi mereka boleh mengandungi lebih banyak elektron.
Boleh melayani anda: Batch Reactor: Ciri, Bahagian, AplikasiSeperti yang ditunjukkan, konfigurasi elektronik setiap elemen adalah unik untuk kedudukannya dalam jadual berkala. Tahap tenaga ditentukan oleh tempoh, dan bilangan elektron diberikan oleh bilangan atom unsur.
Orbital pada tahap tenaga yang berbeza adalah serupa antara satu sama lain, tetapi menduduki kawasan yang berbeza di ruang angkasa.
Orbital 1s dan 2s orbital mempunyai ciri -ciri orbital s (nod radio, kebarangkalian jumlah sfera, hanya boleh mengandungi dua elektron, dll.). Tetapi, seperti yang berada di tahap tenaga yang berbeza, mereka menduduki ruang yang berbeza di sekitar nukleus. Setiap orbital boleh diwakili oleh blok tertentu dalam jadual berkala.
Blok S adalah rantau logam alkali, termasuk helium (kumpulan 1 dan 2), blok D adalah logam peralihan (kumpulan 3 hingga 12), blok p adalah unsur -unsur kumpulan utama kumpulan 13 A 18, dan blok F ialah Siri lantanida dan actinid.
Prinsip Aufbau
Aufbau berasal dari perkataan Jerman Aufbauen, Apa maksud "membina". Pada dasarnya, ketika menulis konfigurasi elektron, kita sedang membina orbital elektron ketika kita maju dari satu atom ke yang lain.
Semasa kita menulis konfigurasi elektronik atom, kita akan mengisi orbital dalam meningkatkan urutan nombor atom.
Prinsip Aufbau berasal dari prinsip pengecualian Pauli, yang mengatakan tidak ada dua fermion (contohnya, elektron) dalam atom. Mereka boleh mempunyai set nombor kuantum yang sama, jadi mereka perlu "mengumpul" pada tahap tenaga yang lebih tinggi.
Cara elektron terkumpul adalah isu konfigurasi elektron.
Atom yang stabil mempunyai banyak elektron seperti yang dilakukan oleh proton dalam nukleus. Elektron bertemu di sekitar nukleus dalam orbital kuantum, mengikuti empat peraturan asas yang disebut prinsip aufbau.
Boleh melayani anda: barium chloride (bacl2)1. Tidak ada dua elektron dalam atom yang dikongsi oleh empat nombor kuantum yang sama N, L, M dan S.
2. Elektron akan terlebih dahulu menduduki orbital tahap tenaga terendah.
3. Elektron akan mengisi orbital selalu dengan nombor putaran yang sama. Apabila orbital penuh, ia akan bermula.
4. Elektron akan mengisi orbital untuk jumlah nombor kuantum n dan l. Orbital dengan nilai yang sama (n + l) akan diisi terlebih dahulu dengan nilai n yang lebih rendah.
Peraturan kedua dan keempat pada dasarnya sama. Contoh Peraturan Empat adalah orbital 2p dan 3s.
2p orbital adalah n = 2 dan l = 2 dan orbital 3s ialah n = 3 dan l = 1. (N + l) = 4 dalam kedua -dua kes, tetapi orbital 2p mempunyai tenaga terendah atau nilai yang lebih rendah dan akan diisi sebelum lapisan 3s.
Nasib baik, anda boleh menggunakan rajah Moeller yang ditunjukkan untuk mengisi elektron. Grafik dibaca dengan melaksanakan pepenjuru dari 1s.
 Rajah Moeller. Sumber: Gabriel Bolívar
Rajah Moeller. Sumber: Gabriel Bolívar Sekarang diketahui bahawa urutan orbital diisi, satu -satunya perkara yang tersisa adalah menghafal saiz setiap orbital.
Orbital mempunyai 1 kemungkinan nilai mL Mengandungi 2 elektron
Orbital p mempunyai 3 nilai yang mungkin mL Mengandungi 6 elektron
Orbital mempunyai 5 kemungkinan nilai mL Mengandungi 10 elektron
Orbital f mempunyai 7 nilai yang mungkinL Mengandungi 14 elektron
Ini semua yang diperlukan untuk menentukan konfigurasi elektronik atom stabil elemen.
Contohnya, ambil elemen nitrogen. Nitrogen mempunyai tujuh proton dan, oleh itu, tujuh elektron. Orbital pertama yang akan diisi adalah 1s orbital.
Orbital s mempunyai dua elektron, jadi terdapat lima elektron yang tersisa. Orbital seterusnya adalah orbital 2s dan mengandungi dua seterusnya. Tiga elektron terakhir akan pergi ke orbital 2p yang boleh mengandungi sehingga enam elektron.
Boleh melayani anda: carboxymethylcelluloseKepentingan konfigurasi elektronik luaran
Konfigurasi elektron memainkan peranan penting dalam menentukan sifat atom.
Semua atom kumpulan yang sama mempunyai konfigurasi elektronik luaran yang sama dengan pengecualian nombor atom n, itulah sebabnya mereka mempunyai sifat kimia yang sama.
Beberapa faktor utama yang mempengaruhi sifat atom termasuk saiz orbital yang diduduki terbesar, tenaga orbital tenaga yang paling banyak, bilangan kekosongan orbital dan bilangan elektron dalam orbital tenaga yang lebih besar.
Sebilangan besar sifat atom boleh dikaitkan dengan tahap tarikan antara elektron luaran ke nukleus dan bilangan elektron di lapisan elektron paling luar, bilangan elektron valensi.
Elektron lapisan luar adalah yang boleh membentuk ikatan kimia kovalen, yang mempunyai keupayaan untuk membentuk kation atau anion dan yang memberikan keadaan pengoksidaan kepada unsur -unsur kimia.
Mereka juga akan menentukan jejari atom. Apabila n menjadi lebih besar, jejari atom meningkat. Apabila atom kehilangan elektron, akan ada penguncupan jejari atom akibat penurunan beban negatif di sekitar nukleus.
Elektron lapisan luar diambil kira oleh teori pautan Valencia, teori medan kristal dan teori orbital molekul untuk mendapatkan sifat -sifat molekul dan hibridisasi bon.
Rujukan
- Aufbau Main. Chem pulih.Libretxts.org.
- Sains Bozeman. Konfigurasi elektron. Pulih dari YouTube.com.
- Konfigurasi elektron dan sifat atom. Pulih dari Oneonta.Edu.

