Jari zink, struktur, klasifikasi, fungsi
- 2439
- 233
- Ismael Turner
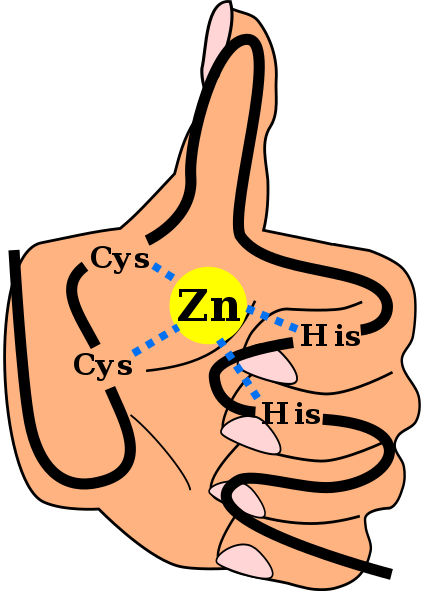
 Struktur utama domain jari zink C2H2, termasuk pautan yang menyelaraskan ion zink dan dengan latar belakang "tangan dan jari". Angel Herraez, Wikimedia Commons
Struktur utama domain jari zink C2H2, termasuk pautan yang menyelaraskan ion zink dan dengan latar belakang "tangan dan jari". Angel Herraez, Wikimedia Commons The Jari zink (ZF) adalah motif struktur yang terdapat dalam sejumlah besar eukariot. Mereka tergolong dalam kumpulan metalloprotein, kerana mereka dapat menyatukan ion logam zink, yang mereka perlukan untuk operasinya. Dianggap bahawa lebih daripada 1500 domain ZF wujud di sekitar 1000 protein yang berbeza pada manusia.
Istilah zink jari atau "jari zink" pertama kali dicipta pada tahun 1985 oleh Miller, McLachlan dan Klug, sambil mengkaji secara terperinci domain kecil DNA DNA faktor transkripsi TFIIIa dari Xenopus laevis, diterangkan oleh penulis lain beberapa tahun sebelumnya.
Protein dengan motif ZF adalah yang paling banyak dalam genom organisma eukariotik dan mengambil bahagian dalam kepelbagaian proses selular yang penting, di antaranya transkripsi genetik, terjemahan protein, metabolisme, lipatan dan pemasangan protein dan lipid lain menonjol, kematian sel yang diprogramkan, yang lain.
Struktur
Struktur motif ZF sangat dipelihara. Biasanya kawasan berulang ini mempunyai 30 hingga 60 asid amino, yang struktur sekundernya seperti dua helaian antiparallel beta yang membentuk garpu dan proksi alfa, yang dilambangkan sebagai ββα.
Struktur sekunder ini stabil oleh interaksi hidrofobik dan oleh koordinasi atom zink yang diberikan oleh dua sistein dan dua sisa histidin (Cys2Dia2). Walau bagaimanapun, terdapat ZF yang boleh menyelaraskan lebih daripada satu atom zink dan lain -lain di mana urutan Cys dan sisinya berbeza -beza.
Boleh melayani anda: asid palmitholeik: struktur, fungsi, di mana iaZFS boleh diulang dalam batch, dikonfigurasi secara linear dalam protein yang sama. Semua mempunyai struktur yang sama, tetapi mereka dapat membezakan diri mereka secara kimia dengan variasi sisa asid amino utama untuk memenuhi fungsi mereka.
Ciri umum antara ZF adalah keupayaannya untuk mengenali molekul DNA atau RNA dengan panjang yang berbeza, itulah sebabnya mereka pada mulanya dianggap hanya faktor transkriptif.
Secara umum, pengiktirafan adalah kawasan 3pb dalam DNA dan dicapai apabila protein dengan domain ZF membentangkan kipas alfa ke alur utama molekul DNA.
Klasifikasi
Terdapat sebab ZF yang berbeza yang berbeza antara satu sama lain dengan sifat mereka dan konfigurasi ruang yang berbeza yang mencapai pautan koordinasi dengan atom zink. Salah satu klasifikasi adalah seperti berikut:
C2H2
Ini adalah alasan yang biasa dijumpai di ZF. Sebilangan besar sebab c2H2 Mereka khusus untuk interaksi dengan DNA dan RNA, bagaimanapun, mereka telah diperhatikan mengambil bahagian dalam interaksi protein-protein. Mereka mempunyai antara 25 dan 30 sisa asid amino dan berada dalam keluarga terbesar protein pengawalseliaan dalam mamalia.
C2H
Berinteraksi dengan RNA dan beberapa protein lain. Mereka terutamanya diperhatikan sebagai sebahagian daripada beberapa protein kapsul retrovirus, bekerjasama dalam pembungkusan RNA virus selepas replikasi.
C4 (gelung atau pita)
Protein dengan motif ini adalah enzim yang bertanggungjawab untuk replikasi dan transkripsi DNA. Contoh yang baik ini boleh menjadi enzim mentah phages T4 dan T7.
C4 (Keluarga Gata)
Keluarga ZF ini merangkumi faktor transkripsi yang mengawal ekspresi gen penting dalam pelbagai tisu semasa pembangunan sel. Sebagai contoh, Gata-2 dan 3 faktor terlibat dalam hematopoiesis.
Ia boleh melayani anda: ATP (Adenosine Triffosphate)C6
Domain ini adalah tipikal ragi, khususnya protein GAL4, yang mengaktifkan transkripsi gen yang terlibat dalam penggunaan galaktosa dan melibious.
Jari zink (c3HC4-C3H2C3)
Struktur tertentu ini mempunyai 2 subtipe domain ZF (c3HC4 dan c3H2C3) dan terdapat dalam banyak protein haiwan dan tumbuhan.
Mereka ditemui dalam protein seperti Rad5, yang terlibat dalam pembaikan DNA dalam organisma eukariotik. Mereka juga terdapat dalam RAG1, sangat diperlukan untuk konfigurasi semula imunoglobulin.
H2C2
Domain ZF ini sangat dipelihara dalam integral retrovirus dan retrotransposon; Semasa menyertai protein putih, ia menyebabkan perubahan konformasi yang sama.
Fungsi
Protein Domain ZF melayani pelbagai tujuan: Mereka boleh didapati dalam protein ribosom atau penyesuai transkriptif. Mereka juga telah dikesan sebagai sebahagian daripada struktur polimerase RNA II ragi.
Mereka seolah -olah terlibat dalam homeostasis zink intraselular dan dalam peraturan apoptosis atau kematian sel yang diprogramkan. Di samping itu, terdapat beberapa protein ZF yang berfungsi sebagai pendamping untuk lipatan atau pengangkutan protein lain.
Kesatuan lipid dan peranan asas dalam interaksi protein-protein juga merupakan fungsi yang luar biasa dari domain ZF dalam beberapa protein.
Kepentingan bioteknologi
Selama bertahun -tahun, pemahaman struktur dan fungsi domain ZF telah membolehkan kemajuan saintifik yang besar yang membayangkan penggunaan ciri -ciri mereka untuk tujuan bioteknologi.
Oleh kerana beberapa protein ZF mempunyai kekhususan yang hebat kerana domain DNA tertentu, banyak usaha yang kini dilaburkan dalam reka bentuk ZF tertentu, yang dapat memberikan kemajuan yang berharga dalam terapi gen pada manusia.
Ia boleh melayani anda: Flora dan Fauna China: Spesies WakilAplikasi bioteknologi yang menarik juga timbul dari reka bentuk protein dengan ZF yang diubahsuai oleh kejuruteraan genetik. Bergantung pada akhir yang dikehendaki, sesetengahnya boleh diubahsuai dengan penambahan jari dengan jari "poli zink", yang mampu mengenali urutan DNA dengan pertalian dan kekhususan yang hebat.
Edisi Genomik dengan Nukleus Modified adalah salah satu aplikasi yang paling menjanjikan hari ini. Edisi jenis ini menawarkan kemungkinan menjalankan kajian mengenai fungsi genetik secara langsung dalam sistem minat.
Kejuruteraan Genetik Menggunakan ZF Nucleasas yang diubahsuai telah menarik perhatian saintis dalam bidang peningkatan genetik kultivar kepentingan agronomi. Nukleus ini telah digunakan untuk membetulkan gen endogen yang menghasilkan bentuk herba -herba dalam tumbuhan tembakau.
Nukleus dengan ZF juga telah digunakan untuk penambahan gen dalam sel mamalia. Protein yang dipersoalkan digunakan untuk menghasilkan satu set sel tetikus isogenik dengan satu siri alel yang ditakrifkan untuk gen endogen.
Proses sedemikian mempunyai aplikasi langsung dalam pelabelan dan penciptaan bentuk alel baru untuk mengkaji struktur dan hubungan fungsi dalam keadaan ekspresi asli dan dalam persekitaran isogenik.
Rujukan
- Berg, j. M. (1990). Domain Jari Zink: Hipotesis dan Pengetahuan Semasa. Kajian Tahunan Biofizik dan Kimia Biofizik, 19(39), 405-421.
- Kluska, k., Adamczyk, j., & Krȩzel, a. (2017). Sifat mengikat logam jari zink dengan laman web mengikat logam secara semula jadi. Metallomics, 10(2), 248-263.

