Derivatif halogenasi

- 1967
- 50
- Anthony Breitenberg
Kami menerangkan apa derivatif halogenasi, sifat, kegunaan/aplikasi mereka dan kami memberikan beberapa contoh
Apakah derivatif halogenasi?
The derivatif halogenasi Mereka semua adalah sebatian yang mempunyai atom halogen; iaitu, mana -mana elemen kumpulan 17 (f, cl, br, i). Unsur -unsur ini berbeza dari yang lain kerana mereka lebih elektronegatif, membentuk kepelbagaian halida bukan organik dan organik.
Imej halogen yang lebih rendah ditunjukkan pada gambar yang lebih rendah. Dari atas ke bawah: Fluoride (F2), Klorin (CL2), Bromo (br2) dan iodin (i2). Setiap ini mempunyai keupayaan untuk bertindak balas dengan sebahagian besar unsur -unsur, termasuk antara congeners kumpulan yang sama (interhalogens).

Oleh itu, derivatif halogenasi mempunyai formula MX jika ia adalah haluro logam, rx jika alkil dan arx jika aromatik. Dua yang terakhir terletak dalam kategori Haluros Organik. Kestabilan sebatian ini memerlukan "manfaat" tenaga di hadapan molekul soda asal.
Sebagai peraturan umum, fluorida membentuk halogenasi lebih stabil daripada yodin. Sebabnya disebabkan oleh perbezaan antara radio atom mereka (sfera ungu lebih besar daripada yang kuning).
Dengan meningkatkan jejari atom, tumpang tindih orbital antara halogen dan atom yang lain lebih miskin dan, oleh itu, pautan itu lebih lemah.
Nomenclature
Cara untuk menamakan sebatian ini dengan betul bergantung kepada sama ada mereka tidak organik atau organik.
Bukan organik
Halida logam terdiri daripada ikatan, ionik atau kovalen, antara halogen x dan logam M (kumpulan 1 dan 2, logam peralihan, logam berat, dll.).
Dalam sebatian ini semua halogen mempunyai keadaan pengoksidaan -1. Kerana? Kerana konfigurasi Valencia adalah ns2Np5.
Oleh itu, mereka perlu memenangi hanya satu elektron untuk melengkapkan oktet Valencia, sementara logam mengoksidakan, memberi mereka elektron yang mereka miliki.
Boleh melayani anda: keseimbangan ketepatan: ciri, fungsi, bahagian, kegunaanOleh itu, fluorida kekal sebagai f-, fluorida; Cl-, klorida; br-, bromida; dan i-, Saya terakhir. MF akan dinamakan: Fluoride of (Nama Logam) (N), yang menjadi Nalencia del Metal hanya apabila ia mempunyai lebih daripada satu. Dalam kes kumpulan kumpulan 1 dan 2, tidak perlu menamakan Valencia.
Contoh
- NAF: Natrium fluorida.
- CACL2: kalsium klorida.
- AGBR: Bromida Perak.
- Zni2: Zinc Yoduro.
- CUCL: Tembaga Klorida (i).
- Cucl2: Tembaga klorida (ii).
- Ticl4: Titanium klorida (iv) atau titano tetrachloride.
Walau bagaimanapun, elemen hidrogen dan bukan logam - walaupun halogen yang sama - juga boleh membentuk haluros. Dalam kes ini, Valencia No Metal tidak dilantik pada akhirnya:
- Pcl5: Phosphorus pentachloride.
- Bf3: Boro trifluoruro.
- Ali3: Aluminium triyoduro.
- HBR: bromida hidrogen.
- Jika7: Heptofluoride iodine.
Organik
Tidak kira sama ada Rx atau Arx, halogen kovalen dikaitkan dengan atom karbon. Dalam kes ini, halogen disebutkan oleh nama mereka, dan selebihnya tatanama bergantung kepada struktur molekul R atau AR.
Untuk molekul organik yang paling mudah, metana (CHO4), Derivatif berikut diperoleh dengan menggantikan H dengan Cl:
- Ch3CL: Chloromethane.
- Ch2Cl2: dichloromethane.
- Chcl3: tricyloromethane (kloroform).
- CCL4: Tetrachloromethane (karbon klorida (iv) atau karbon tetraklorida).
Di sini r terdiri daripada satu atom karbon. Kemudian, untuk rantai alifatik lain (linear atau cawangan) bilangan karbon dikira dari mana ia dikaitkan dengan halogen:
Ch3Ch2Ch2F: 1-fluorpropano.
Contoh sebelumnya ialah halida alqilical primer. Sekiranya rantai bercabang, yang paling lama mengandungi halogen dipilih dan mula mengira, meninggalkan nombor yang mungkin:
Boleh melayani anda: apakah sifat fizikal perkara?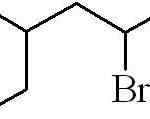
3-methyl-5-Bromohexan
Dengan cara yang sama berlaku untuk substituen lain. Juga, untuk halida aromatik halogen dilantik dan kemudian seluruh struktur:

Imej unggul menunjukkan kompaun yang dipanggil bromobenzene, menonjolkan atom bromin dalam coklat.
Sifat derivatif halogenasi
Halida bukan organik
Halida bukan organik adalah pepejal ionik atau molekul, walaupun bekasnya lebih banyak. Bergantung pada interaksi dan radio ionik MX, ini akan larut dalam air atau pelarut kutub yang lain.
Halida bukan logam (seperti boro) biasanya asid Lewis, yang bermaksud bahawa mereka menerima elektron untuk membentuk kompleks. Sebaliknya, halida (atau halogenuros) hidrogen dibubarkan dalam air menghasilkan apa yang dikenali sebagai hidrasid.
Titik leburnya, mendidih atau sublimasi jatuh pada interaksi elektrostatik atau kovalen antara logam atau tidak -metal dengan halogen.
Begitu juga, radio ionik memainkan peranan penting dalam sifat -sifat ini. Contohnya, jika m+ dan x- Mereka mempunyai saiz yang sama, kristal mereka akan lebih stabil.
Halida organik
Mereka adalah kutub. Kerana? Kerana perbezaan elektronegativiti antara C dan halogen mencipta momen kutub tetap dalam molekul. Juga, ini berkurangan apabila kumpulan 17 turun, dari pautan c-f ke c-i.
Tanpa mempertimbangkan struktur molekul R atau AR, bilangan halogen yang semakin meningkat secara langsung mempengaruhi titik mendidih, kerana ia meningkatkan jisim molar dan interaksi intermolecular (RC-X-X-CR). Kebanyakannya tidak dapat dilepaskan dengan air, tetapi mereka boleh membubarkan pelarut organik.
Penggunaan derivatif halogenasi
Penggunaan derivatif halogenasi dapat menempah teks mereka sendiri. "Sahabat" molekul halogen adalah faktor utama, memandangkan sifat dan reaktiviti mereka menentukan penggunaan derivatif.
Boleh melayani anda: kalium sulfat (K2SO4): Struktur, sifat, kegunaan, sintesisOleh itu, di antara kepelbagaian besar yang mungkin digunakan, yang berikut menonjol:
- Halogen molekul digunakan untuk membuat mentol halogen, di mana anda berhubung dengan filamen tungsten pijar. Tujuan campuran ini adalah untuk bertindak balas halogen x dengan tungsten yang disejat. Dengan cara ini pemendapannya dielakkan di permukaan mentol, menjamin lebih banyak masa hidup.
- Garam fluorur digunakan dalam fluorisasi perairan pergigian dan pasta.
- Natrium dan Hipoklorit Kalsium adalah dua ejen aktif dalam penyelesaian pemutihan komersial (klorin).
- Walaupun mereka merosot lapisan ozon, chlorofluorocarbons (CFCs) digunakan dalam aerosol dan sistem penyejukan.
- Vinyl Chloride (CHO2= CHCl) adalah monomer polyvinyl polimer klorida (PVC). Sebaliknya, Teflon, yang digunakan sebagai bahan tidak berfungsi, terdiri daripada rantaian polimer tetrafluorethylene (f2C = cf2).
- Mereka digunakan dalam kimia analisis dan sintesis organik untuk tujuan yang berbeza; Antaranya, sintesis dadah.
Contoh tambahan

Imej unggul menggambarkan hormon tiroid, yang bertanggungjawab untuk pengeluaran haba serta peningkatan metabolisme umum dalam badan. Kompaun ini adalah contoh derivatif halogenasi yang ada di dalam tubuh manusia.
Antara sebatian halogen yang lain, yang berikut disebut:
- Diclorodifenilriclorootan (DDT), racun serangga yang cekap tetapi dengan kesan alam sekitar yang serius.
- Tin Chloride (SNNCL2), digunakan sebagai ejen pengurangan.
- Chloroethane atau 1-chloroethane (CH3Ch2Cl), anestetik topikal yang bertindak dengan cepat menyejukkan kulit.
- Dichloroethylene (clch = cclh) dan tetrachlorethylene (CL2C = CCL2), digunakan sebagai pelarut dalam industri cucian kering.
- « Struktur kimia, sifat dan kegunaan silikon karbida
- 80 frasa untuk cinta pertama yang tidak pernah dilupakan »

