Struktur, Ciri, Kegunaan, Risiko Karbon Disulfida Karbon (CS2)
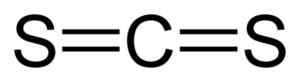
- 4469
- 554
- Anthony Breitenberg
Dia karbon disulfida Ia adalah sebatian yang dibentuk oleh kesatuan atom karbon (c) dan dua atom sulfur. Formula kimianya adalah cs2. Ia adalah cecair yang tidak berwarna atau sedikit kuning dengan bau yang tidak menyenangkan kerana kekotoran yang mengandungi (sebatian sulfur). Apabila bau murni lembut dan manis, serupa dengan kloroform atau eter.
Ia secara semula jadi berasal dari tindakan cahaya matahari pada molekul organik yang terdapat di dalam air laut. Di samping itu, ia berlaku di perairan paya dan juga diusir dari gunung berapi bersama dengan gas lain.
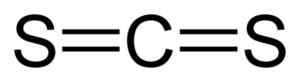 CS karbon disulfida2. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons.
CS karbon disulfida2. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons. Karbon disulfida adalah cecair yang tidak menentu dan juga sangat mudah terbakar, jadi ia mesti disimpan dari api dan percikan atau peranti yang dapat menghasilkannya, termasuk mentol elektrik.
Ia mempunyai keupayaan untuk membubarkan sejumlah besar sebatian, bahan dan elemen, seperti fosforus, sulfur, selenium, resin, lacquers, dll. Oleh itu ia mendapat utiliti sebagai pelarut.
Ia juga perantara dalam pelbagai tindak balas kimia perindustrian, seperti pengeluaran rayon atau sutera buatan.
Ia mesti dimanipulasi dengan berhati -hati dan dengan pelaksanaan perlindungan kerana ia sangat toksik dan berbahaya.
[TOC]
Struktur
Karbon disulfida mempunyai atom karbon dan dua atom belerang di sisi ini.
Hubungan antara atom karbon dan atom sulfur adalah kovalen dan berganda, oleh itu mereka sangat kuat. Molekul CS2 Ia mempunyai struktur linear dan simetri.
 Struktur linear karbon disulfida cs2. Hitam = karbon, kuning = sulfur. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons.
Struktur linear karbon disulfida cs2. Hitam = karbon, kuning = sulfur. Pengarang: Benjah-bmm27. Sumber: Wikimedia Commons. Nomenclature
- Karbon disulfida
- Karbon bisulfida
- Anhydride Ditiocarbonic
Sifat
Keadaan fizikal
Tidak berwarna kepada kekuningan.
Berat molekul
76.15 g/mol
Titik gabungan atau pemejalan
-110.8 ° C
Takat didih
46.0 ºC
Titik kilat
-30 ºC (kaedah cawan tertutup).
Suhu sendiri
90 ° C
Ketumpatan
Cecair = 1.26 g/cm3 pada 20 ºC.
Wap = 2.67 kali udara.
Wapnya lebih dari dua kali ganda berat daripada udara dan cecair lebih berat daripada air.
Tekanan wap
279 mmhg pada 25 ° C.
Boleh melayani anda: Potassium Hypochlorite (KCLO)Ini adalah tekanan stim yang tinggi.
Kelarutan
Larut air yang sangat sedikit: 2.16 g/l A 25 ° C. Larut dalam kloroform. Saja dengan etanol, metanol, eter, benzena, kloroform dan karbon tetraklorida.
Sifat kimia
CS2 Ia menguap dengan mudah pada suhu bilik kerana titik mendidihnya sangat rendah dan tekanan stimnya sangat tinggi.
Karbon disulfida sangat mudah terbakar. Wapnya sangat mudah meradang, walaupun dengan panas mentol lampu elektrik. Ini bermaksud bahawa ia bertindak balas dengan oksigen dengan cepat:
Cs2 + 3 o2 → Co2 + 2 Jadi2
Fakta bahawa anda mempunyai tekanan stim yang tinggi pada suhu bilik menjadikannya berbahaya untuk dekat dengan api.
Apabila dipanaskan hingga penguraian dapat dengan mudah mengeksploitasi, memancarkan gas toksik dari oksida sulfur. Melebihi 90 ° C ia dihidupkan secara spontan.
Ia rosak apabila disimpan untuk masa yang lama. Serangan tembaga dan aloi. Ia juga bertindak balas dengan beberapa plastik, karet dan salutan.
Bertindak balas di bawah keadaan tertentu dengan air, membentuk OCS carbonyl sulfide, arang batu dioksida Co2 dan hidrogen disulfida h2S:
Cs2 + H2O → ocs + h2S
Cs2 + 2 jam2O → co2 + 2 jam2S
Dengan alkohol (ROH) dalam bentuk alkali bentuk Xantates (RO-CS-NNA):
Cs2 + ROH + NaOH → H2Atau + ro -c (= s) -sna
Memperoleh
Disulfida karbon disediakan secara komersil oleh tindak balas sulfur dengan arang batu. Proses ini dijalankan pada suhu 750-900 ° C.
C + 2 s → cs2
Daripada arang batu, anda juga boleh menggunakan metana atau gas asli, dan juga etana, propana dan propilena telah digunakan, di mana reaksi berlaku pada 400-700 ° C dengan prestasi tinggi.
Ia juga boleh disediakan dengan bertindak balas dengan gas asli dengan hidrogen sulfida h2S suhu yang sangat tinggi.
Kehadiran dalam alam
CS2 Ia adalah produk semulajadi yang ada di atmosfera dalam kuantiti yang sangat kecil (jejak). Ia berlaku secara fotokimia di perairan permukaan.
Tindakan cahaya matahari pada sebatian tertentu yang terdapat di dalam air laut seperti sistein (asid amino) membawa kepada pembentukan karbon disulfida.
 Disulfida karbon boleh dibentuk oleh tindakan sinar solar pada beberapa sebatian organik yang terdapat di dalam air laut. Pengarang: Pexels. Sumber: Pixabay.
Disulfida karbon boleh dibentuk oleh tindakan sinar solar pada beberapa sebatian organik yang terdapat di dalam air laut. Pengarang: Pexels. Sumber: Pixabay. Ia juga secara semulajadi dikeluarkan semasa letusan gunung berapi dan terdapat dalam kuantiti kecil di atas paya.
Boleh melayani anda: benzaldehydeBiasanya kita terdedah untuk bernafas dalam perkadaran yang sangat kecil dan terdapat dalam beberapa makanan. Ia juga dijumpai di asap rokok.
Di persekitaran ia terurai melalui cahaya matahari. Di atas tanah ia bergerak melaluinya. Beberapa mikroorganisma tanah rosak.
Aplikasi
Dalam industri kimia
Karbon disulfida adalah sebatian kimia penting kerana ia berfungsi untuk menyediakan bahan kimia lain. Boleh bertindak sebagai perantara kimia.
Ia juga digunakan sebagai pelarut proses misal.
Membolehkan pembuatan produk farmaseutikal dan herba, antara lain.
Dalam pengeluaran Rayón dan Celofán
Dengan CS2 Xantatos disediakan yang digunakan dalam pembuatan Rayón dan Celofán.
Untuk mendapatkan sutera buatan atau rayon, ia berdasarkan selulosa yang dirawat dengan alkali dan karbon disulfida CS2 dan berubah menjadi selulosa xantate, larut dalam alkali. Penyelesaian ini likat dan oleh itu dipanggil "viscosa".
Viscose dibuat di bawah tekanan melalui lubang yang sangat kecil di dalam mandi asid. Di sini selulosa xantate berubah lagi menjadi selulosa yang tidak larut dan benang panjang dan cerah terbentuk.
Benang atau filamen boleh diputar untuk memberikan bahan yang dikenali sebagai Rayón.
(1) selulosa + naOH → alkali-celulosa
ROH + NaOH → Rona
(2) Alkali-celulosa + disulfida karbon → selulosa xantate
Rona + s = c = s → ro -c (= s) -sna
(3) xantate selulosa + asid → selulosa (filamen)
RO -C (= S) -SNA + Asid → ROH
 Pakaian yang dibuat dengan rayon, serat yang pembuatannya mengambil bahagian disulfida karbon. Tobias "Take" Maier [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Pakaian yang dibuat dengan rayon, serat yang pembuatannya mengambil bahagian disulfida karbon. Tobias "Take" Maier [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Sekiranya selulosa dicetuskan dengan melewati Xantato melalui slot sempit, selulosa diperbaharui dalam bentuk lembaran nipis yang membentuk selofan. Ini dilembutkan dengan gliserol dan digunakan sebagai filem pelindung objek.
 Selofan dihasilkan dengan bantuan karbon disulfida. Pengarang: Hans Braxmeier. Sumber: Pixabay.
Selofan dihasilkan dengan bantuan karbon disulfida. Pengarang: Hans Braxmeier. Sumber: Pixabay. Dalam pengeluaran karbon tetraklorida
Karbon disulfida bertindak balas dengan cl klorin2 Untuk memberi ccl karbon tetrachloride4, yang merupakan pelarut penting yang bukan bahan bakar.
Boleh melayani anda: chlorobenzene (c6h5cl)Cs2 + 3 Cl2 → CCL4 + S2Cl2
Dalam beberapa aplikasi
Disulfida karbon mengambil bahagian dalam pembubaran getah sejuk.
Xantatos disediakan dengan CS2 Ia digunakan dalam pengapungan mineral.
Kegunaan lama
CS2 Ia adalah racun untuk organisma hidup. Dahulu ia digunakan untuk memusnahkan perosak seperti tikus, marmot dan semut, menuangkan cecair di setiap ruang tertutup di mana haiwan ini hidup (burrows dan hormigueros))).
Apabila wap toksik yang padat digunakan untuk tujuan ini, mereka mengakhiri setiap organisma hidup yang berada di ruang terkurung.
Ia juga digunakan sebagai antihelmintik untuk haiwan dan menghapuskan larva dari Moscardon dari perut kuda.
Dalam bidang pertanian ia digunakan sebagai insektisida dan nematicide, untuk memusnahkan tanah, untuk pengasingan tapak semaian, lumbung, silo dan kilang bijirin. Kereta kereta api, kapal dan tongkang juga fumigasi.
 Petani pada tahun 1904 memusnahkan tanah dengan karbon disulfida untuk memerangi wabak tumbuhan anggur. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/lesen/lesen lama/fdl-1.2.html)]. Sumber: Wikimedia Commons.
Petani pada tahun 1904 memusnahkan tanah dengan karbon disulfida untuk memerangi wabak tumbuhan anggur. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/lesen/lesen lama/fdl-1.2.html)]. Sumber: Wikimedia Commons. Semua kegunaan ini dilarang kerana mudah terbakar dan ketoksikan CS2.
Risiko
CS2 Ia sangat mudah terbakar. Banyak reaksi anda boleh menyebabkan kebakaran atau letupan. Campuran wap mereka dengan udara meletup. Semasa meremehkan menghasilkan gas yang menjengkelkan atau toksik.
Karbon disulfida untuk longkang tidak boleh dicurahkan, kerana di dalam tiub terdapat campuran cs2 dan udara yang boleh menyebabkan letupan jika ia menyala secara tidak sengaja.
Wapnya api secara spontan berhubung dengan percikan api atau permukaan panas.
Karbon disulfida teruk merengsa mata, kulit dan membran mukus.
Sekiranya sistem saraf pusat dihirup atau ditelan dengan serius, sistem kardiovaskular, mata, buah pinggang dan hati. Ia juga boleh diserap melalui kulit yang menyebabkan kerosakan.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2020). Karbon disulfida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- MOPPER, k. Dan Kieber, D.J. (2002). Fotokimia dan berbasikal karbon, sulfur, nitrogen dan pospherus. Dalam biogeokimia bahan organik yang dibubarkan marin. Pulih dari Scientedirect.com.
- Meyer, b. (1977). Penggunaan Sulfur Perindustrian dan Compundsnya. Karbon disulfida. Dalam sulfur, tenaga, dan iri hati. Pulih dari Scientedirect.com.
- Pohanish, r.P. (2012). C. Karbon disulfida. Dalam buku panduan bahan kimia dan karsinogen yang beracun dan berbahaya Sittig (edisi keenam). Pulih dari Scientedirect.com.
- Morrison, r.T. dan Boyd, r.N. (2002). Kimia organik. Edisi ke -6. Prentice-Hall.
- Windholz, m. et al. (editor) (1983). Indeks Merck. Eniklopedia bahan kimia, ubat, dan biologi. Edisi Kesepuluh. Merck & Co., INC.
- « 95 frasa terbaik orang kudus Katolik
- +105 frasa Katolik mengenai iman, refleksi, doa dan harapan »

