Struktur, SO2) Sulfur (SO2) Struktur, Kegunaan, Risiko

- 3810
- 444
- Miss Elmer Hagenes
Dia sulfur dioksida Ia adalah sebatian bukan organik gas yang dibentuk oleh sulfur dan oksigen (o), sebagai formula kimianya begitu2. Ia adalah gas tanpa warna dengan bau yang menjengkelkan dan mencekik. Di samping itu, ia adalah larut air yang membentuk penyelesaian asid. Gunung berapi mengusirnya ke arah atmosfera semasa letusan.
Ia adalah sebahagian daripada kitaran biologi dan geokimia sulfur, tetapi dihasilkan dalam kuantiti yang banyak oleh aktiviti manusia tertentu seperti penapisan minyak dan bahan bakar fosil yang terbakar (arang batu atau diesel misalnya).
 Sulfur dioksida jadi2 dikeluarkan oleh gunung berapi semasa letusan. Brocken Inaglory [cc by-s (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Sulfur dioksida jadi2 dikeluarkan oleh gunung berapi semasa letusan. Brocken Inaglory [cc by-s (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. So2 Ia adalah ejen pengurangan yang membolehkan pulpa kertas kekal putih selepas pengubahan wang haram dengan sebatian lain. Ia juga berfungsi untuk menghapuskan klorin kekal di dalam air yang telah dirawat dengan ahli kimia ini.
Ia digunakan untuk menyimpan beberapa jenis makanan, untuk membasmi bekas di mana penapaian jus anggur berlaku untuk menghasilkan wain atau barli untuk membuat bir.
Ia juga digunakan sebagai fungisida dalam bidang pertanian, untuk mendapatkan asid sulfurik, sebagai pelarut dan sebagai perantara dalam reaksi kimia.
So2 Hadir di atmosfera berbahaya kepada banyak tumbuhan, di dalam air ikan mempengaruhi dan juga salah satu yang bertanggungjawab untuk "hujan asid" yang menghancurkan bahan -bahan yang dicipta oleh manusia.
[TOC]
Struktur
Molekul sulfur dioksida adalah simetri dan membentuk sudut. Sudutnya adalah kerana SO2 Ia mempunyai beberapa elektron kesepian, iaitu elektron yang membentuk hubungan dengan atom tetapi bebas.
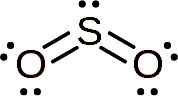 Struktur lewis sulfur dioksida di mana bentuk sudutnya dan sepasang elektron bebas diperhatikan. Whittlemario [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Struktur lewis sulfur dioksida di mana bentuk sudutnya dan sepasang elektron bebas diperhatikan. Whittlemario [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Nomenclature
- Sulfur dioksida
- Sulfur anhydride
- Oksida sulfur.
Sifat
Keadaan fizikal
Gas tidak berwarna.
Berat molekul
64.07 g/mol
Takat lebur
-75.5 ºC
Takat didih
-10.05 ºC
Ketumpatan
Gas: 2.26 hingga 0 ° C (berbanding dengan udara, iaitu, ketumpatan udara = 1). Ini bermaksud bahawa ia lebih berat dari udara.
Cecair: 1.4 a -10 ° C (berbanding dengan air, iaitu, ketumpatan air = 1).
Kelarutan
Air larut: 17.7% pada 0 ° C; 11.9% pada 15 ° C; 8.5% pada 25 ° C; 6.4% pada suhu 35 ° C.
Larut dalam etanol, ketetan, aseton dan kloroform. Ia kurang larut dalam pelarut non -polar.
Ph
Penyelesaian SOS berair2 Mereka berasid.
Sifat kimia
So2 Ia adalah ejen pengurangan dan pengoksidaan yang kuat. Di hadapan udara dan pemangkin mengoksidakan begitu3.
SW2 + Sama ada2 → So3
Pasangan elektron bersendirian menjadikannya kadang -kadang berkelakuan sebagai pangkalan Lewis, dengan kata lain, ia dapat bertindak balas dengan sebatian di mana terdapat atom yang hilang elektron.
Ia boleh melayani anda: pemfailan besi: sifat, bagaimana mereka dibuat, ketoksikan, kegunaanKalau begitu2 Ia dalam bentuk gas dan kering tidak menyerang besi, keluli, aloi tembaga-nikel, atau nikel-chrome-hydrro. Walau bagaimanapun, jika ia berada dalam keadaan cair atau lembap, ia menghasilkan kakisan kepada logam -logam ini.
So2 Cecair dengan 0.2% air atau lebih menghasilkan besi, tembaga dan kakisan tembaga yang kuat. Ia menghakis aluminium.
Apabila cecair anda juga boleh menyerang beberapa plastik, getah dan lapisan.
SOS berair begitu2
So2 Ia sangat larut dalam air. Ia dianggap lama bahawa dalam bentuk asid sulfur air h2SW3, Tetapi kewujudan asid ini belum ditunjukkan.
Dalam penyelesaiannya2 Di dalam air, baki berikut berlaku:
SW2 + H2Atau ⇔ Jadi2.H2Sama ada
SW2.H2Atau ⇔ HSO3- + H3Sama ada+
Hso3- + H2Atau ⇔ Jadi32- + H3Sama ada+
Di mana hso3- Ia adalah ion bisulfite dan SO32- Ia adalah ion sulfit. Ion sulfit begitu32- Ia berlaku terutamanya apabila alkali ditambah kepada penyelesaian SO2.
Penyelesaian SOS berair2 Mereka telah mengurangkan sifat, terutama jika mereka beralkali.
Sifat lain
- Ia sangat stabil berbanding haba, sehingga 2000 ° C.
- Ia tidak mudah terbakar.
Memperoleh
So2 Ia diperolehi oleh pembakaran sulfur di udara, walaupun sejumlah kecil bentuk juga terbentuk3.
S + o2 → So2
Ia juga boleh dihasilkan oleh pemanasan di udara pelbagai sulfida, membakar mineral pirit dan mineral yang mengandungi sulfida, antara lain.
Dalam kes pirit besi, apabila mengoksidakan oksida besi (III) dan SO diperolehi2:
4 fes2 + 11 o2 → 2 iman2Sama ada3 + 8 Jadi2↑
Kehadiran dalam alam
So2 Ia dilepaskan ke atmosfera oleh aktiviti gunung berapi (9%) tetapi juga berasal dari aktiviti semula jadi lain (15%) dan oleh tindakan manusia (76%).
Letusan gunung berapi letupan menyebabkan turun naik atau variasi tahunan yang ketara2 di atmosfera. Dianggarkan 25% daripada SO2 Dipancarkan oleh gunung berapi dibasuh oleh hujan sebelum sampai ke stratosfera.
Sumber semula jadi adalah yang paling banyak dan disebabkan oleh kitaran biologi sulfur.
Di kawasan bandar dan perindustrian, sumber manusia mendominasi. Aktiviti manusia utama yang menghasilkannya adalah pembakaran bahan api fosil, seperti arang batu, petrol dan diesel. Sumber manusia lain adalah kilang minyak, tumbuhan kimia dan pengeluaran gas.
 Aktiviti manusia seperti pembakaran arang batu untuk elektrik adalah sumber pencemaran dengan begitu2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Aktiviti manusia seperti pembakaran arang batu untuk elektrik adalah sumber pencemaran dengan begitu2. ADREM68 [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Dalam mamalia ia dihasilkan dengan cara endogen, iaitu, dalam tubuh haiwan dan manusia akibat metabolisme asid amino yang mengandungi sulfur, terutama L-cysteine.
Boleh melayani anda: elemen cecair: apakah dan contohnyaAplikasi
Dalam pengeluaran asid sulfurik
Salah satu aplikasi terpenting SO2 Ia memperoleh asid sulfurik h2SW4.
2 Jadi2 + 2 jam2Atau + o2 → 2 h2SW4
Dalam industri makanan yang diproses
Sulfur dioksida digunakan sebagai pengawet makanan dan penstabil, sebagai ejen untuk kawalan kelembapan dan sebagai pengubah rasa dan tekstur produk yang boleh dimakan tertentu.
Ia juga digunakan untuk membasmi peralatan yang bersentuhan dengan barangan runcit, peralatan penapaian, seperti kilang bir dan vital, bekas makanan, dll.
Ia membolehkan untuk memulihara buah -buahan dan sayur -sayuran, meningkatkan kehidupannya di rak pasar raya, menghalang kehilangan warna dan rasa dan membantu dalam pengekalan vitamin C (asid askorbik) dan karoten (prekursor vitamin A).
 Buah -buahan kering tetap bebas daripada kulat dan bakteria terima kasih kepada SO2. Pengarang: Isabel Ródenas. Sumber: Pixabay.com
Buah -buahan kering tetap bebas daripada kulat dan bakteria terima kasih kepada SO2. Pengarang: Isabel Ródenas. Sumber: Pixabay.com Ia berfungsi untuk menjaga wain, kerana ia memusnahkan bakteria, kulat dan ragi yang tidak diingini. Ia juga digunakan untuk mensterilkan dan mencegah pembentukan nitrosamin dalam bir.
 Peralatan penapaian barli untuk mendapatkan bir disterilkan dengan begitu2. Pengarang: Ceridebbie. Sumber: Pixabay.
Peralatan penapaian barli untuk mendapatkan bir disterilkan dengan begitu2. Pengarang: Ceridebbie. Sumber: Pixabay. Ia juga digunakan untuk merendam bijirin jagung, untuk memotong gula bit dan sebagai antimikrob dalam pembuatan sirap jagung yang tinggi.
Sebagai pelarut dan reaktif
Ia telah digunakan secara meluas sebagai pelarut yang tidak bersuara. Walaupun ia bukan pelarut pengion, ia berguna sebagai pelarut bebas daripada proton untuk aplikasi analisis dan tindak balas kimia tertentu.
Ia digunakan sebagai pelarut dan reagen dalam organik, perantara dalam pengeluaran sebatian lain seperti klorin dioksida, asetil klorida dan sulfoni minyak.
Sebagai ejen pengurangan
Ia digunakan sebagai ejen pengurangan walaupun tidak begitu kuat, dan dalam larutan alkali ion sulfit dibentuk yang merupakan ejen pengurangan yang lebih bertenaga.
Dalam beberapa aplikasi
So2 Ia juga digunakan:
- Dalam bidang pertanian seperti pengawet fungisida dan anggur selepas menuai.
- Untuk mengeluarkan hydrosulfite.
- Untuk meluntur kayu dan pulpa kertas, kerana ia membolehkan menstabilkan pulpa selepas mencubanya dengan hidrogen peroksida h2Sama ada2; So2 bertindak dengan memusnahkan h2Sama ada2 sisa dan dengan itu menjaga kecerahan pulpa, sebagai h2Sama ada2 boleh menyebabkan pembalikan kecerahan.
- Untuk peluntur gentian tekstil dan artikel rotan.
- Untuk merawat perairan, ia menghapuskan klorin sisa yang kekal selepas pengklorinan air minuman, air kumbahan atau perindustrian.
- Dalam penapisan mineral dan logam, sebagai ejen pengurangan besi semasa pemprosesan mineral.
- Dalam penapisan minyak untuk menangkap oksigen dan menangguhkan kakisan, dan sebagai pelarut pengekstrakan.
Boleh melayani anda: mengimbangi persamaan kimia- Sebagai antioksidan.
- Sebagai neutralizer alkali dalam pembuatan kaca.
- Dalam bateri litium sebagai ejen pengoksidaan.
Kesan SO2 endogen
Kajian tertentu telah menunjukkan bahawa SO2 endogen atau dihasilkan oleh organisma itu sendiri mempunyai kesan yang baik pada sistem kardiovaskular, termasuk peraturan fungsi jantung dan kelonggaran saluran darah.
Apabila SO berlaku dalam organisma2 Ia menjadi derivatif bisulfite hso3- dan sulfit begitu32-, yang memberikan kesan vasorelajador arteri.
So2 endogen menurunkan hipertensi, menghalang perkembangan aterosklerosis dan melindungi jantung kerosakan miokardium. Ia juga melakukan tindakan antioksidan, menghalang keradangan dan apoptosis (kematian sel yang diprogramkan).
Atas sebab -sebab ini, ia dianggap bahawa ia boleh menjadi terapi baru yang mungkin untuk penyakit kardiovaskular.
 Hati dapat mendapat manfaat dari SO2 dihasilkan oleh organisma. Pengarang: OpenClipart-Vectors. Sumber: Pixabay.
Hati dapat mendapat manfaat dari SO2 dihasilkan oleh organisma. Pengarang: OpenClipart-Vectors. Sumber: Pixabay. Risiko
- Pendedahan kepada SO2 Gaseous boleh menyebabkan luka bakar di mata, kulit, tekak dan membran mukus, kerosakan pada bronkus dan paru -paru.
- Beberapa kajian melaporkan bahawa ia mempunyai potensi risiko kerosakan bahan genetik sel mamalia dan manusia.
- Ia menghakis. Ia tidak mudah terbakar.
Ecotoxicity
Sulfur dioksida adalah gas pencemar yang paling biasa di atmosfera, terutama di kawasan bandar dan perindustrian.
Kehadirannya di atmosfera menyumbang kepada "hujan asid" yang dibebankan yang berbahaya kepada organisma akuatik, ikan, tumbuh -tumbuhan tanah dan kakisan kepada bahan -bahan yang dibuat oleh manusia.
 Monumen yang rosak oleh hujan asid. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Monumen yang rosak oleh hujan asid. Nino Barbieri [CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikimedia Commons. So2 Ia beracun untuk ikan. Tumbuhan hijau sangat sensitif terhadap begitu2 atmosfera. Alfalfa, kapas, barli dan gandum rosak dengan paras persekitaran yang rendah, manakala kentang, bawang dan jagung jauh lebih tahan.
Kesan menelannya dengan makanan
Walaupun tidak berbahaya kepada orang yang sihat, apabila digunakan dalam kepekatan yang disyorkan oleh agensi kesihatan yang diberi kuasa, SO2 boleh mendorong asma kepada orang yang sensitif yang menelannya dengan makanan.
 Orang yang sensitif boleh mengalami asma dengan meminum makanan dengan sedikit2. Suraj di Malayalam Wikipedia [domain awam]. Sumber: Wikimedia Commons.
Orang yang sensitif boleh mengalami asma dengan meminum makanan dengan sedikit2. Suraj di Malayalam Wikipedia [domain awam]. Sumber: Wikimedia Commons. Makanan yang biasanya mengandungi buah -buahan kering, minuman ringan buatan dan minuman beralkohol.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Dioksida sulfur. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Huang, dan. et al. (2016). Sulfur Dioksida Endogen: Keluarga Gasotransmitter Baru dalam Sistem Kardiovaskular. Longev sel med oksid. 2016; 2016: 8961951. NCBI pulih.NLM.NIH.Gov.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Windholz, m. et al. (editor) (1983). Indeks Merck. Eniklopedia bahan kimia, ubat, dan biologi. Edisi Kesepuluh. Merck & Co., INC.
- Roti, x. (2011). Oksida sulfur: sumber, pendedahan dan kesan kesihatan. Kesan kesihatan oksida sulfur. Dalam ensiklopedia kesihatan alam sekitar. Pulih dari Scientedirect.com.
- Tricker, R. dan menipu, s. (1999). Pencemar dan bahan cemar. Sulfur dioksida. Dalam keperluan alam sekitar untuk peralatan elektromekanik dan elektronik. Pulih dari Scientedirect.com.
- BLEAM, W. (2017). Asid-asas kimia. Oksida sulfur. Dalam Kimia Tanah dan Alam Sekitar (edisi kedua). Pulih dari Scientedirect.com.
- Freedman, b.J. (1980). Sulfur dioksida dalam makanan dan minuman: menggunakan pengawet dan kesannya terhadap asma. Br J diss dada. 1980; 14 (2): 128-34. NCBI pulih.NLM.NIH.Gov.
- Craig, k. (2018). Kajian semula kimia, penggunaan racun perosak, dan nasib alam sekitar sulfur dioksida, seperti yang digunakan di California. Dalam ulasan pencemaran alam sekitar dan toksikologi. Jilid 246. Pautan pulih.Springer.com.
- « Struktur silikon nitruro (SI3N4), sifat, penggunaan, penggunaan
- Struktur polilorida aluminium, sifat, mendapatkan, menggunakan »

