Struktur tertiari ciri -ciri utama ciri

- 5091
- 533
- Julius Dibbert
The Struktur protein tertiari Ini adalah penyesuaian tiga dimensi yang rantai polipeptida diperoleh ketika melipat pada diri mereka. Konformasi ini muncul dengan interaksi antara rantai sisi sisa asid amino polipeptida. Rantai sampingan dapat berinteraksi secara bebas dari kedudukan mereka dalam protein.
Kerana ia bergantung kepada interaksi antara kumpulan R, struktur tertiari menunjukkan aspek yang tidak rapet dari rantai, kerana kumpulan ini berbeza untuk setiap residu asid amino. Struktur sekunder, sebaliknya, bergantung kepada kumpulan karboksil dan amino, yang terdapat dalam semua asid amino.
 Struktur tertiari protein fosfatase kinase, dengan struktur sekunder dalam daun alpha dan beta. Diambil dan diedit dari: A2-33. Diubahsuai oleh Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Struktur tertiari protein fosfatase kinase, dengan struktur sekunder dalam daun alpha dan beta. Diambil dan diedit dari: A2-33. Diubahsuai oleh Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Beberapa penulis mencadangkan bahawa protein berserabut mempunyai struktur tersier yang mudah, tetapi bagaimanapun, penulis lain menunjukkan bahawa struktur ini adalah tipikal protein globular.
[TOC]
Protein berserabut
Dalam protein berserabut, rantai polipeptida disusun dalam bentuk filamen panjang atau lembaran panjang; Mereka biasanya terdiri daripada jenis struktur sekunder yang unik. Struktur sekunder ini, dalam kebanyakan kes, lebih penting daripada struktur tersier dalam menentukan bentuk protein.
Fungsi biologinya adalah struktur, memberikan kekuatan dan/atau keanjalan kepada organ dan struktur di mana mereka dijumpai, sambil menjaga mereka bersama. Semua protein berserabut tidak larut dalam air, kerana banyak asid amino hidrofobik yang mereka sampaikan.
Antara protein berserabut ini adalah keratin dan kolagen. Yang pertama ditemui dalam kain konjungtif dan dalam struktur seperti rambut, kuku (α-queratinas), skala dan bulu (β-cheatins). Sementara itu, kolagen ditemui di tulang, tendon dan kulit, antara lain.
α-Queratinas
Protein ini adalah sebahagian daripada protein filamen pertengahan yang dipanggil, yang memainkan peranan penting dalam sitoskeleton organisma multiselular. Di samping itu, mereka adalah penyusun utama rambut, kuku, bulu, tanduk, kuku, dan salah satu protein kulit haiwan utama.
Boleh melayani anda: pewarnaan kinyounStruktur molekul adalah kipas α. Dua helai α-Queratin dapat diatur selari dan mendaftarkan satu lagi dengan kumpulan hidrofobik R mereka yang berinteraksi di antara mereka. Dengan cara ini struktur superhelic atau bola dicipta dengan penggulungan ke kiri.
Struktur tertiari α keratin adalah mudah dan dikuasai oleh struktur sekunder α-helix. Sebaliknya, struktur Quaternary juga hadir, kerana dua molekul mengambil bahagian dalam struktur superhelicoidal, yang berinteraksi melalui ikatan bukan kovalen.
β-Queratinas
Struktur utama adalah serupa dengan α-Queratinas, tetapi struktur sekundernya dikuasai oleh lembaran β. Mereka adalah penyusun utama skala reptilia dan bulu burung.
Kolagen
Protein ini boleh mewakili lebih daripada 30% daripada jumlah jisim protein beberapa haiwan. Ia terdapat dalam kartilagos, tulang, tendon, kornea dan kulit, antara tisu lain.
Struktur sekunder kolagen adalah unik, diwakili oleh kipas levogira dengan sisa asid amino 3.3 untuk setiap pangkuan. Tiga rantai kipas levogi (α).
Molekul Tropocollagen bersatu untuk membentuk serat kolagen yang mempunyai rintangan yang besar, lebih tinggi daripada keluli dan setanding dengan tembaga rintangan yang tinggi.
Protein berserabut lain
Jenis lain protein berserabut adalah fibroin dan elastin. Yang pertama dibentuk oleh lembaran β, terutamanya yang dibentuk oleh glycina, alanine dan serine.
Rantaian sisi asid amino ini kecil, jadi mereka boleh dibungkus dengan teliti. Hasilnya adalah serat yang kedua -duanya sangat tahan dan sangat tidak dikurangkan.
Boleh melayani anda: penampan fosfat (PBS): asas, penyediaan dan kegunaanSementara itu, dalam elastin, valin menggantikan serine di antara asid amino konstituen utamanya. Tidak seperti fibroine, elastin sangat extensible, oleh itu namanya. Dalam Perlembagaan Molekul, Lysine juga bertindak, yang boleh mengambil bahagian dalam silang yang membolehkan elastin memulihkan bentuknya apabila ketegangan berhenti.
Protein globular
Protein globular, tidak seperti berserabut, larut dan umumnya mempunyai beberapa jenis struktur sekunder. Walau bagaimanapun, dalam hal ini adalah lebih penting tiga -dimensi penyesuaian yang mereka peroleh ketika melipat pada diri mereka (struktur tertiari).
Konformasi tiga dimensi tertentu ini memberikan aktiviti biologi tertentu kepada setiap protein. Fungsi utama protein ini adalah pengawalseliaan, seperti dengan enzim.
Ciri -ciri struktur tertiari protein globular
Struktur tertiari protein globular mempunyai beberapa ciri penting:
- Protein globular adalah padat terima kasih kepada pembungkusan apabila lipatan rantai polipeptida.
- Sisa asid amino jauh dalam struktur utama rantai polipeptida adalah dekat, dapat berinteraksi antara satu sama lain kerana lipatan.
- Protein globular yang lebih besar (lebih daripada 200 asid amino) boleh mempunyai beberapa segmen padat, bebas di antara mereka dan dengan fungsi tertentu, dan setiap segmen ini dipanggil domain. Domain boleh mempunyai antara 50 dan 350 sisa asid amino.
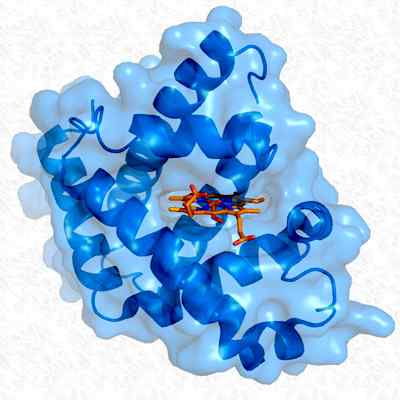 Struktur myoglobin tertiari. Diambil dan diedit dari: Thomas Splettstoesser. Diubahsuai oleh Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Struktur myoglobin tertiari. Diambil dan diedit dari: Thomas Splettstoesser. Diubahsuai oleh Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Peraturan umum lipatan protein global
Seperti yang telah dinyatakan, protein mempunyai bentuk lipat tertentu, yang memberi mereka juga ciri -ciri tertentu. Lipat ini tidak rawak dan disukai oleh struktur primer dan sekunder dan oleh beberapa interaksi bukan -kovalen, dan terdapat juga beberapa sekatan fizikal untuk lipatan, jadi beberapa peraturan telah dirumuskan:
Boleh melayani anda: organ limfoid utama- Semua protein globular mempunyai corak pengedaran yang ditetapkan, dengan kumpulan hidrofobik yang diarahkan ke dalam sisa molekul dan hidrofilik di lapisan luar di lapisan luar. Untuk ini, sekurang -kurangnya dua lapisan struktur sekunder diperlukan. Gelung β-α-β dan puncak α-α dapat menyumbang kedua-dua lapisan tersebut.
- Lembaran β biasanya diatur dalam bentuk levogira.
- Dalam rantai polipeptida, giliran yang berbeza boleh berlaku untuk bergerak dari sekunder ke struktur lain, seperti β atau γ giliran, yang dapat melabur arah rantai menjadi empat sisa asid amino atau kurang.
- Protein globular mempunyai lembaran α, β, sentuhan dan segmen berstruktur yang tidak teratur.
Denaturasi protein
Sekiranya protein kehilangan struktur tiga dimensi asli (semulajadi), ia kehilangan aktiviti biologi dan sebahagian besar sifatnya. Proses ini dikenali sebagai denaturasi.
Denaturasi boleh berlaku apabila keadaan alam semula jadi berubah, contohnya dengan suhu atau pH yang berbeza -beza. Proses ini tidak dapat dipulihkan dalam banyak protein; Walau bagaimanapun, yang lain secara spontan dapat memulihkan struktur semula jadi mereka dengan memulihkan keadaan persekitaran yang normal.
Rujukan
- C.K. Mathews, k.Dan. Van hold & k.G. Ahern (2002). Biokimery. Edisi ke -3. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, ms. Mayes, d.C. Granner & v.W. Rodwell (1996). Biokimer Harper. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biokimery. Edisi ke -5. W. H. Freeman dan Syarikat.
- W.M. Becker, l.J. Kleinsmith & J. Hardin (2006) Dunia Sel. Edisi ke -6. Pearson Education Inc.
- Ke.Lehninger (1978). Biokimia. Edisi omega, s.Ke.
- T. McKee & J.R. McKee (2003). Biokimia: Asas Molekul Kehidupan. Edisi ke -3. The McGraw-Hiii Companies, Inc.
- « Sifat kondensat fermionik, aplikasi dan contoh
- Struktur, Sodium Dodecil Sodium Sulfate (SDS), Kegunaan »

