Etano
- 1067
- 134
- Horace Gulgowski
 Struktur Estano
Struktur Estano Apa itu Ethane?
Dia Etano Ia adalah hidrokarbon formula C yang mudah2H6 Dengan sifat gas tanpa warna dan tandas yang mempunyai penggunaan yang sangat berharga dan pelbagai dalam sintesis etilena. Di samping itu, ia adalah salah satu gas tanah yang juga telah dikesan di planet dan badan bintang lain di sekitar sistem suria. Ia ditemui oleh saintis Michael Faraday pada tahun 1834.
Antara sebilangan besar sebatian organik yang dibentuk oleh atom karbon dan hidrogen (dikenali sebagai hidrokarbon), terdapat yang berada dalam keadaan gas pada suhu dan tekanan alam sekitar, yang sangat digunakan dalam banyak industri.
Ini biasanya berasal dari campuran gas yang dipanggil "gas asli", produk yang bernilai tinggi untuk kemanusiaan, dan membentuk jenis metana, etana, propana dan butana, antara lain; layak mengikut jumlah atom karbon dalam rantai.
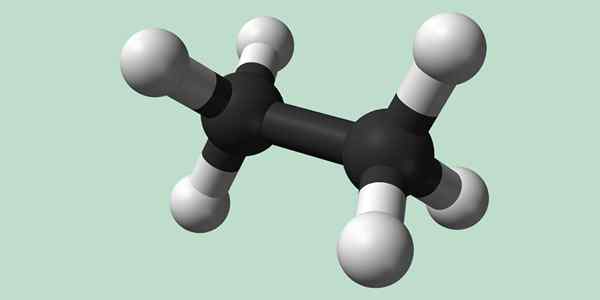
Struktur kimia etana
Estano adalah molekul formula C2H6, biasanya dilihat sebagai kesatuan dua kumpulan metil (-ch3) Untuk membentuk hidrokarbon ikatan karbon-karbon sederhana. Ia juga merupakan sebatian organik yang paling mudah selepas metana, mewakili dirinya sendiri:
H3C-ch3
Atom karbon dalam molekul ini mempunyai hibridisasi jenis SP3, Jadi ikatan molekul mempunyai putaran percuma.
Terdapat juga fenomena intrinsik Etano, yang berdasarkan putaran struktur molekulnya dan tenaga minimum yang diperlukan untuk menghasilkan putaran pautan 360 -Degree, yang disebut saintis "Etano barrera".
Atas sebab ini, Ethan.
 Struktur kimia etana. Sumber: Wikimedia Commons
Struktur kimia etana. Sumber: Wikimedia Commons Sintesis etana
Estano dengan mudah boleh disintesis dari elektrolisis Kolbe, tindak balas organik di mana dua langkah berlaku: decarboxylation elektrokimia (penyingkiran kumpulan karboksil dan pembebasan karbon dioksida) dari dua asid karboksilik, dan gabungan produk intermediates untuk membentuk ikatan kovalen.
Begitu juga, elektrolisis asid asetik menghasilkan pembentukan etana dan karbon dioksida, dan tindak balas ini digunakan untuk mensintesis yang pertama.
Pengoksidaan anhidrida asetik oleh tindakan peroksida, konsep yang serupa dengan elektrolisis Kolbe, juga menghasilkan pembentukan etana.
Dapat melayani anda: sumbangan dari kimia kepada manusiaDengan cara yang sama, ia dapat dipisahkan dengan cekap dari gas asli dan metana dengan proses pencairan, menggunakan sistem kriogenik untuk menangkap gas ini dan memisahkannya dari campuran dengan gas lain.
Proses pengembangan turbo adalah kegemaran untuk peranan ini: campuran gas dibuat oleh turbin, menghasilkan pengembangannya, sehingga suhunya jatuh di bawah -100 ° C.
Sudah pada ketika ini, komponen campuran dapat dibezakan, jadi etana cecair dari metana gas dan spesies lain yang terlibat dengan penggunaan penyulingan akan dipisahkan.
Hartanah Estano
Estano dibentangkan sebagai tandas dan gas tanpa warna kepada tekanan dan suhu standard (1 atm dan 25 ° C). Ia mempunyai titik mendidih -88.5 ° C, dan titik gabungan -182.8 ° C. Di samping itu, ia tidak terjejas oleh pendedahan kepada asid atau pangkalan yang kuat.
Kelarutan Ethane
Molekul etano adalah konfigurasi simetri dan mempunyai daya tarikan yang lemah yang menyatukannya, yang disebut daya penyebaran.
Apabila etana cuba membubarkan air, daya tarikan yang terbentuk antara gas dan cecair sangat lemah, sehingga etana tidak akan bergabung dengan molekul air.
Atas sebab ini, kelarutan etana agak rendah, meningkat sedikit apabila tekanan sistem meningkat.
Penghabluran etana
Estano dapat dipertahankan, menjadikan kristal etana yang tidak stabil dengan struktur kristal padu.
Dengan penurunan suhu melebihi -183.2 ° C, struktur ini menjadi monoklinik, meningkatkan kestabilan molekulnya.
Pembakaran etana
Hidrokarbon ini, walaupun tidak digunakan secara meluas sebagai bahan bakar, boleh digunakan dalam proses pembakaran untuk menghasilkan karbon dioksida, air dan haba, yang diwakili seperti berikut:
2 c2H6 + Ke -72 → 4co2 + 6H2O + 3120 kJ
Terdapat juga kemungkinan membakar molekul ini tanpa oksigen yang berlebihan, yang dikenali sebagai "pembakaran tidak lengkap", dan yang menghasilkan pembentukan karbon amorf dan karbon monoksida dalam reaksi yang tidak diingini, menurut jumlah oksigen yang digunakan:
Boleh melayani anda: sterol: struktur, fungsi dan contoh2 c2H6 + Ke -32 → 4c + 6h2Atau + panas
2 c2H6 + Ke -42 → 2c + 2co + 6h2Atau + panas
2 c2H6 + 5th2 → 4co + 6h2Atau + panas
Di kawasan ini, pembakaran berlaku dengan satu siri tindak balas radikal bebas, yang bernombor dalam beratus -ratus reaksi yang berbeza. Sebagai contoh, dalam sebatian reaksi pembakaran yang tidak lengkap seperti formaldehid, acetaldehid, metana, metanol dan etanol boleh dibentuk.
Ini bergantung kepada keadaan di mana tindak balas dan tindak balas radikal bebas yang terlibat berlaku. Etilena juga boleh terbentuk pada suhu tinggi (600-900 ° C), yang merupakan produk yang sangat diinginkan oleh industri.
Estano di atmosfera dan di badan angkasa
Estano hadir di atmosfera planet bumi di jejak, dan disyaki bahawa manusia telah berjaya menggandakan kepekatan ini sejak dia mula mengamalkan kegiatan perindustrian.
Para saintis berpendapat bahawa sebahagian besar kehadiran ETA semasa di atmosfera adalah disebabkan oleh pembakaran bahan api fosil, walaupun pelepasan dunia etana telah menurun hampir separuh sejak teknologi pengeluaran gas lutita bertambah baik (sumber gas asli).
Spesies ini juga berlaku secara semulajadi dengan kesan sinar solar pada metana atmosfera, yang rekombin dan membentuk molekul etana.
Terdapat etana dalam keadaan cair di permukaan Titan, salah satu bulan Saturnus. Ini dibentangkan dalam kuantiti yang lebih besar di Sungai Vid Flumina, yang mengalir lebih dari 400 kilometer ke salah satu lautannya. Kompaun ini juga telah dibuktikan pada komet, dan di permukaan Pluto.
Penggunaan etana
Pengeluaran etilena
Penggunaan etana didasarkan terutamanya pada pengeluaran etilena, produk organik penggunaan yang lebih besar dalam pengeluaran dunia, melalui proses yang dikenali sebagai Steam Stage.
Proses ini terdiri daripada lulus Ethan yang dicairkan.
Reaksi berlaku pada suhu yang sangat tinggi (antara 850 dan 900 ° C), tetapi masa kediaman (masa etana berlalu dalam ketuhar) mesti singkat sehingga reaksi itu berkesan. Pada suhu yang lebih tinggi, lebih banyak etilena dihasilkan.
Boleh melayani anda: neon: sejarah, sifat, struktur, risiko, kegunaanPembentukan kimia asas
Etano juga telah dikaji sebagai komponen utama dalam pembentukan bahan kimia asas. Klorinasi oksidatif adalah salah satu proses yang dibangkitkan untuk mendapatkan vinil klorida (komponen PVC), menggantikan orang lain yang kurang ekonomi dan lebih rumit.
Penyejuk
Akhirnya, etana digunakan sebagai penyejuk dalam sistem kriogenik biasa, juga menunjukkan kapasiti pembekuan sampel kecil di makmal untuk analisis.
Ia adalah pengganti air yang sangat baik, yang memerlukan lebih banyak untuk menyejukkan sampel yang halus, dan juga dapat menghasilkan pembentukan kristal ais berbahaya.
Risiko etana
-Estano mempunyai keupayaan untuk menjadi meradang, terutamanya ketika bergabung dengan udara. Peratusan 3.0 hingga 12.5% jumlah etana di udara, campuran letupan boleh dibentuk.
-Ia boleh mengehadkan oksigen di udara di mana ia dijumpai, dan atas sebab ini ia memberikan faktor risiko untuk mati lemas untuk orang dan haiwan yang hadir dan terdedah.
-Ethane dalam bentuk cecair beku mungkin serius membakar kulit jika ia bersentuhan langsung dengannya, dan juga bertindak sebagai medium kriogenik untuk sebarang objek yang menyentuh, membekukannya pada saat -saat.
-Wap etana cecair lebih berat daripada udara dan menumpukan perhatian di atas tanah, ini dapat menimbulkan risiko pencucuhan yang dapat menghasilkan reaksi pembakaran rantai.
-Pengambilan Etano boleh menyebabkan mual, muntah dan pendarahan dalaman. Penyedutan, sebagai tambahan kepada lemas, menyebabkan sakit kepala, kekeliruan dan perubahan humor. Kematian akibat penangkapan jantung adalah mungkin di pameran yang tinggi.
-Ia mewakili gas rumah hijau yang, bersama -sama dengan metana dan karbon dioksida, menyumbang kepada pemanasan global dan perubahan iklim yang dihasilkan oleh pencemaran manusia. Nasib baik, ia kurang banyak dan berkekalan daripada metana, dan menyerap radiasi yang kurang daripada ini.
Rujukan
- Britannica, e. (s.F.). Etana. Diperoleh dari Britannica.com
- Nes, g. V. (s.F.). Struktur kristal tunggal dan pengagihan ketumpatan elektron etana, ethilena dan asetilena. Rug pulih.Nl
- Tapak, g. (s.F.). Ethane: sumber dan tenggelam. Diperoleh dari tapak.Google.com
- Softschools (s.F.). Formula Ethane. Pulih dari softschools.com
- Wikipedia (s.F.). Etana. Diperoleh dari dalam.Wikipedia.org

