Model gas ideal, tingkah laku, contoh
- 2125
- 406
- Anthony Breitenberg
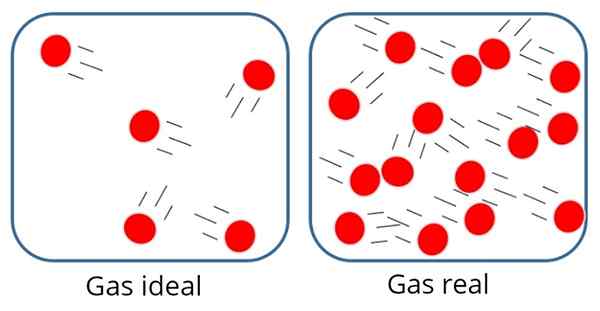
A Gas ideal Sama ada Gas yang sempurna Ia adalah satu di mana daya tarikan atau penolakan molekul dianggap tidak penting antara zarah -zarah yang mengarangnya, oleh itu, semua tenaga dalamannya adalah kinetik, iaitu tenaga yang berkaitan dengan pergerakan itu.
Dalam gas sedemikian, zarah biasanya agak jauh dari satu sama lain, walaupun kadang -kadang bertembung antara satu sama lain dan dengan dinding bekas.
 Dalam gas yang ideal, zarah -zarahnya jauh dari satu sama lain
Dalam gas yang ideal, zarah -zarahnya jauh dari satu sama lain Sebaliknya, di dalam gas ideal saiz atau jisim zarah tidak penting, kerana jumlah yang diduduki olehnya sepatutnya sangat kecil berbanding dengan jumlah gas itu sendiri.
Ini, tentu saja, hanya pendekatan, kerana pada hakikatnya selalu ada beberapa tahap interaksi antara atom dan molekul. Kami juga tahu bahawa zarah -zarah itu menduduki ruang dan mempunyai jisim.
Walau bagaimanapun, andaian ini berfungsi dengan baik dalam banyak kes, seperti gas berat molekul yang rendah, dalam pelbagai tekanan dan suhu.
Walau bagaimanapun, gas berat molekul yang tinggi, terutamanya pada tekanan tinggi atau suhu rendah, tidak berkelakuan sama sekali sebagai gas yang ideal dan memerlukan model lain yang dibuat dengan tujuan menggambarkan mereka dengan ketepatan yang lebih besar.
[TOC]
Eksperimen pertama
Undang -undang yang mengawal gas adalah empirikal, iaitu, mereka timbul dari percubaan. Eksperimen yang paling ketara telah dijalankan pada abad ke -17, kelapan belas dan awal abad kesembilan belas.
Pertama adalah Robert Boyle (1627-1691) dan Edme Mariotte (1620-1684), yang secara bebas mengubah suai tekanan dalam gas dan mendaftarkan perubahan mereka kelantangan, mendapati bahawa mereka berkadar songsang: pada tekanan yang lebih besar, kurang jumlahnya.
 Robert Boyle
Robert Boyle Bagi pihaknya, Jacques Charles (1746-1823) menubuhkan jumlah itu dan suhu mutlak berkadar terus, selagi tekanan tetap berterusan.
Ia boleh melayani anda: gelombang pegun: formula, ciri, jenis, contohAmadeo Avogadro (1776-1856) mendapati bahawa dua jumlah yang sama gas yang berbeza mengandungi jumlah zarah yang sama, selagi tekanan dan suhu adalah sama. Dan akhirnya Joseph de Gay Lussac (1778-1850), mengatakan bahawa dengan mengekalkan kelantangan tetap, tekanan dalam gas berkadar terus dengan suhu.
Undang -undang gas ideal
Penemuan ini dinyatakan melalui formula mudah, memanggil p kepada tekanan, V kepada kelantangan, n kepada bilangan zarah dan T Suhu gas yang ideal:
Undang-undang Boyle-Maleotte
Dengan syarat bahawa suhu ditetapkan, yang berikut berlaku:
P⋅V = malar
Charles Law
Apabila gas berada di bawah tekanan berterusan:
V / t = malar
Undang -undang Lussac Gay
Menjaga gas pada jumlah tetap adalah benar bahawa:
p / t = malar
Undang -undang Avogadro
Jumlah gas yang sama, di bawah tekanan dan keadaan suhu yang sama mempunyai bilangan zarah yang sama. Oleh itu kita boleh menulis:
V ∝ n
Di mana n ialah bilangan zarah dan ∝ adalah simbol perkadaran.
Model gas yang ideal
Model gas yang ideal menerangkan gas seperti itu:
-Apabila zarah berinteraksi berbuat demikian untuk masa yang sangat singkat, melalui pertempuran elastik, di mana dorongan dan tenaga kinetik dipelihara.
-Zarah -zarah konstituennya tepat waktu, dengan kata lain, diameternya jauh lebih rendah daripada jarak purata yang mereka bawa antara satu dan perlanggaran lain.
-Daya intermolecular tidak wujud.
-Tenaga kinetik berkadar dengan suhu.
Gas monoatomik - atom yang tidak dikaitkan dengan berat molekul satu sama lain - dalam keadaan standard tekanan dan suhu (tekanan atmosfera dan suhu 0 º c), mereka mempunyai tingkah laku sedemikian mereka.
Ia dapat melayani anda: vy canis majoris: penemuan, ciri, struktur, latihan dan evolusiPersamaan status gas yang ideal
Undang -undang gas di atas digabungkan untuk membentuk persamaan umum yang mengawal tingkah laku gas yang ideal:
V ∝ n
V ∝ t
Oleh itu:
V ∝ n ⋅T
Di samping itu, undang -undang Boyle:
V = malar / p
Kemudian kita boleh mengesahkan bahawa:
V = (tetap x n ⋅T) / p
Pemalar dipanggil pemalar gas Dan ia dilambangkan dengan huruf r. Dengan pilihan ini, persamaan gas yang ideal mengaitkan empat pembolehubah yang menggambarkan keadaan gas, iaitu N, R, P dan T, meninggalkan:
P⋅V = n ⋅ r ⋅T
Persamaan yang agak mudah ini selaras dengan undang -undang gas ideal. Sebagai contoh, jika suhu tetap, persamaan dikurangkan kepada undang-undang Boyle-Maleotte.
Pemalar gas
Seperti yang telah kita katakan sebelum ini, dalam keadaan suhu dan tekanan standard, iaitu, pada 0ºC (273.15 k) dan 1 atmosfera tekanan, tingkah laku banyak gas adalah dekat dengan gas yang ideal. Di bawah syarat -syarat ini, jumlah 1 mol gas adalah 22.414 l.
Kalau macam itu:
R = (p⋅V) / (n ⋅T) = (1 atm x 22.414 l) / (1 mol x 273.15 k) = 0.0821 atm ⋅ l /mol ⋅ k
Pemalar gas juga boleh dinyatakan dalam unit lain, contohnya dalam sistem antarabangsa jika bernilai:
R = 8,314 j mol-1⋅ k-1
Apabila masalah diselesaikan melalui undang -undang gas ideal, mudah untuk memberi perhatian kepada unit -unit di mana pemalar dinyatakan, kerana seperti yang kita dapat lihat, terdapat banyak kemungkinan.
Tingkah laku gas yang ideal
Seperti yang telah kita katakan, mana -mana gas dalam keadaan tekanan dan suhu standard yang berat molekul rendah, berkelakuan sangat dekat dengan gas yang ideal. Oleh itu, persamaan p angani padi.
Ia boleh melayani anda: Model Atom HeisenbergDengan cara ini, kita dapat membayangkan bahagian gas yang ideal terkunci dalam bekas dan dibentuk oleh zarah -zarah kecil, yang kadang -kadang bertembung antara satu sama lain dan dengan dinding bekas, selalu secara elang.
Inilah yang kita lihat dalam animasi berikut bahagian helium, gas mulia dan monoatomik:
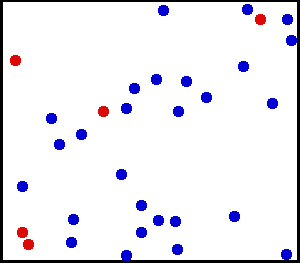 Helium adalah gas mulia, dalam animasi sebahagian daripada atom helium ditunjukkan dalam bekas. Yang merah berfungsi untuk membezakan pergerakan yang lebih baik. Sumber: Wikimedia Commons.
Helium adalah gas mulia, dalam animasi sebahagian daripada atom helium ditunjukkan dalam bekas. Yang merah berfungsi untuk membezakan pergerakan yang lebih baik. Sumber: Wikimedia Commons. Contoh gas ideal
Gas yang ideal adalah gas hipotesis, iaitu, ia adalah idealisasi, bagaimanapun, dalam amalan banyak gas berkelakuan dengan cara yang sangat dekat, sehingga memungkinkan untuk model p ⋅V = n ⋅ r ⋅ T tepat.
Gas mulia
Contoh gas yang berkelakuan sebagai cita -cita di bawah keadaan standard adalah gas mulia, serta gas ringan: hidrogen, oksigen dan nitrogen.
Belon aerostatik
 Model Gas Ideal menerangkan bagaimana belon udara panas. Sumber: Wikimedia Commons.
Model Gas Ideal menerangkan bagaimana belon udara panas. Sumber: Wikimedia Commons. Kepada belon aerostatik Rajah 1 boleh digunakan oleh undang -undang Charles: gas dipanaskan, oleh itu udara yang mengisi dunia berkembang dan sebagai akibatnya ia naik.
Helium belon
Helium adalah, bersama -sama dengan hidrogen, elemen yang paling biasa di alam semesta, namun ia jarang berlaku di bumi. Sebagai gas mulia tidak aktif, tidak seperti hidrogen, jadi belon penuh helium digunakan secara meluas sebagai elemen hiasan.
Rujukan
- Atkins, ms. 1999. Kimia Fizikal. Edisi Omega.
- Chang, R. 2013. Kimia. 11va. Edisi. Pendidikan MC Graw Hill.
- Cengel, dan. 2012. Thermodynamics. Edisi ke -7. McGraw Hill.
- Cimbala, c. 2006. Mekanik cecair, asas dan aplikasi. Mc. Graw Hill.
- GiMbattista, a. 2010. Fizik. 2. Ed. McGraw Hill.

