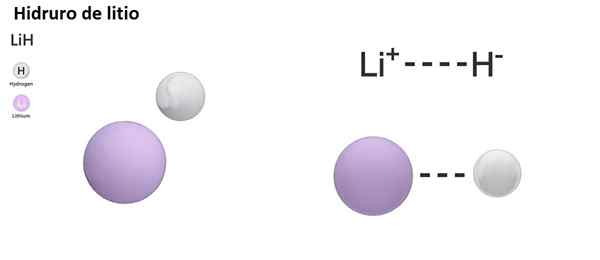Hidror
- 926
- 256
- Ismael Turner
Apa itu hidruros?
Hydros adalah sebatian kimia yang disebabkan oleh tindak balas hidrogen dengan elemen logam (natrium, kalium, kalsium, dll.) dan bukan logam (klorin, fluorin, oksigen, nitrogen, karbon, dll.). Hidrogen bertindak balas dengan hampir semua elemen kimia, jadi hidror adalah bahan yang sangat pelbagai.
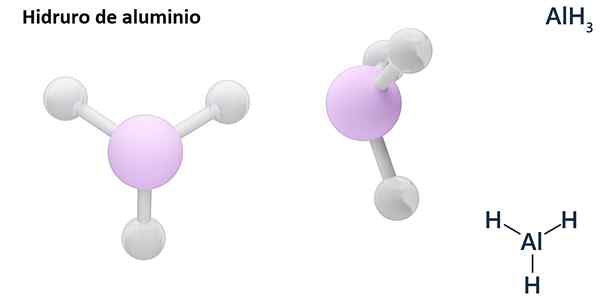
Formula umumnya boleh menjadi jenis MHn, Di mana m adalah logam dan n Valencia (+1, +2, +3), seperti aluminium hidrida, ALH3; atau jenis EHn atau hnDan, di mana e adalah elemen bukan logam dan n Valencia, seperti NH3 atau h2S.
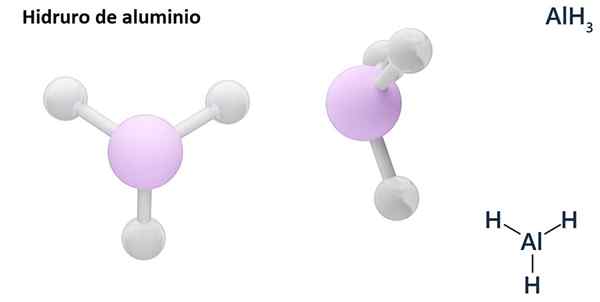
Hydros biasanya adalah sebatian binari, iaitu, hasilnya dari gabungan hidrogen dengan elemen kimia lain. Walau bagaimanapun, hidrogen juga boleh mewujudkan kombinasi dengan beberapa elemen kimia, untuk membentuk hidror yang lebih kompleks. Semua hidror dijelaskan akan menjadi binari, seperti ALH3 dan nah.
Terdapat tiga jenis hidror mengikut sifat ikatan kimianya: ionik, molekul dan logam. Hidror ionik atau salin dicirikan oleh kehadiran ikatan ionik. Pautan ini terdiri daripada tarikan elektrik antara beban positif logam alkali (NA+) atau alkali-bundle (mg2+), dan beban negatif anion hidrida (h-).
Hidrida molekul, sebaliknya, dicirikan oleh pembentukan ikatan kovalen antara hidrogen dan unsur bukan logam. Antara unsur bukan logam yang membentuk hidros adalah: klorin, bromin, fluorin, iodin, oksigen dan nitrogen.
Dan hidror logam disebabkan oleh gabungan hidrogen dengan beberapa logam peralihan. Jenis hidrida ini, tidak seperti yang terdahulu, mempunyai struktur yang kompleks dan tidak akan dijelaskan di sini.
Sifat hidros
Ciri -ciri hidrurns berbeza -beza bergantung kepada jenis hidrida: ionik, molekul atau logam, jadi sifatnya mesti ditunjukkan secara berasingan.
Hidror ionik atau garam
Mereka adalah pepejal putih kristal, tetapi disebabkan kehadiran kekotoran mereka memperoleh warna kelabu. Hidrida ini tidak larut dalam pelarut biasa, seperti air, alkohol, dan lain -lain. Mereka juga mempunyai mata mendidih dan gabungan yang tinggi.
Mereka mempunyai ketumpatan negeri yang tinggi dan cair yang dapat menjalankan elektrik.
Hydurns ionik dianggap asas atau alkali, sejak dibubarkan dalam bentuk air hidroksida dan melepaskan hidrogen molekul:
Nah +h2O → h2 + NaOH
Reaksi hidrida ionik dengan air sangat kuat dan berbahaya: ia menghasilkan hidrogen dalam bentuk gas, yang merupakan bahan mudah terbakar dan mudah terbakar.
Hydurns ionik juga boleh bertindak balas dengan halida logam, yang dibentuk oleh logam dan tidak dikenali sebagai halogen (mx, x = f, cl, br, i):
Boleh melayani anda: dimethylanlin: struktur, sifat, sintesis, kegunaan4 LIH +ALCL3 → Lialh4 + 3 LiCl
LIH (lithium hydride) adalah sebatian binari; manakala lialh4 (Lithium dan aluminium hidrida) adalah sebatian ternary, iaitu, ia terdiri daripada tiga elemen kimia.
Hidros molekul atau kovalen
Mereka berada dalam keadaan cecair atau gas tidak seperti hidror ionik, yang pepejal. Mereka mempunyai titik mendidih dan gabungan yang rendah, memerhatikan bahawa dengan meningkatkan berat molekul hidrida, titik mendidih meningkat; Kecuali ammonia (NH3), Air (h2O) dan fluorida hidrida (HF).
Hidrida kovalen adalah konduktor elektrik yang lemah dan banyak sifat mereka disebabkan oleh pembentukan jambatan hidrogen. Hidrida kovalen dianggap sebagai asid, kerana dibubarkan dalam air boleh menyebabkan asid, contohnya, asid hidroklorik.
Hidror logam
Mereka berada dalam keadaan pepejal, menyampaikan nada gelap logam. Mereka adalah konduktor elektrik yang baik dan mempunyai permukaan yang berkilau. Hidrida logam yang stabil di udara menjadi reagen ketika mereka memanaskan, sebagai contoh, uranium hidrida (uh3) Membentangkan harta ini.
Nomenclature
Cara untuk menamakan hidror adalah mudah, dan tidak terlalu berbeza di mana -mana nomenclatures. Sekiranya logam atau elemen logam mempunyai lebih daripada satu valensi, ia dinyatakan dalam kurungan dan dengan nombor Roman mengikut tatanama saham.
Contohnya, Feh3 dipanggil besi hidrida (III), dan COH2 Cobalt Hydro (II). Hidrida yang sama juga boleh dilantik menggunakan tatanama sistematik, yang menggunakan nombor Yunani (DI, TRI, Tetra, dll.). Oleh itu, Feh3 dipanggil trihydride besi, dan coh2 Cobalt Dihydruro.
Tata nama klasik tidak digunakan secara meluas untuk hidros. Contohnya, NAH lebih dikenali sebagai natrium hidrida, dan bukan natrium hidrida.
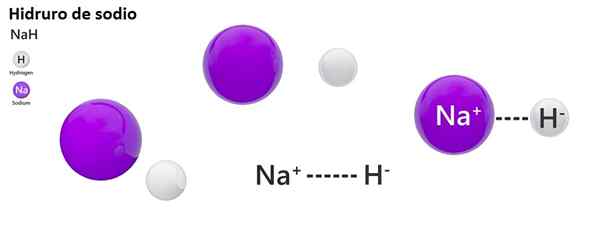 Natrium hidrida
Natrium hidrida Bagaimana hidros terbentuk?
Hidror ionik atau garam
Mereka dibentuk oleh reaksi hidrogen dengan logam milik kumpulan logam alkali atau kumpulan logam alkali-terrero.
Dalam hidror yang dilatih dengan logam ini, hidrogen terdapat dalam bentuk H-, dikenali sebagai anion hidrida.
Logam alkali (litium, natrium, kalium, rubidium dan cesium) bertindak balas dengan hidrogen untuk membentuk hidurns yang sepadan:
2 m (l)+h2(g) → 2mh (s)
Boleh melayani anda: operasi unitLogam m ketika bertindak balas berada dalam keadaan cair, dan hidrogen dalam keadaan gas, jadi reaksi memerlukan suhu tinggi dan tekanan tinggi. Pertimbangkan contoh berikut:
2 li (l) +h2 (g) → 2 Lih (s)
Reaksi hidrogen dengan logam ketiga (berilium, magnesium, kalsium, strontium dan barium), untuk pembentukan hidrida, sama dengan yang diperhatikan dengan logam alkali.
Magnesium dan berilium membentuk hidrida, tetapi ikatan mereka dengan hidrogen adalah jenis kovalen; Iaitu, bukan -ionik, tidak seperti logam alkali lain:
CA (L) +H2 (g) → cah2 (S)
Hidror molekul
Hidrogen boleh bertindak balas dengan bukan logam, sepadan dengan kumpulan 14, 15, 16 dan 17 dari jadual berkala, untuk membentuk hidror molekul. Pertimbangkan, sebagai contoh, pembentukan fluorida hidrida dengan gabungan atau campuran hidrogen langsung dengan fluorin:
H2 (g) +f2 (g) → 2 hf (g)
HF lebih dikenali sebagai fluorida hidrogen, tetapi ia juga dikenali sebagai fluorida hidrida.
Juga, hidrogen boleh bertindak balas dengan oksigen (kumpulan 16 jadual berkala) berikutan skema yang sama:
2 jam2 (g) +atau2 (g) → 2 jam2O (g)
Reaksi memerlukan bekalan haba untuk menghasilkan hidrogen oksida (air) atau hidrida oksigen.
Juga, hidrogen boleh bertindak balas dengan nitrogen, yang dimiliki oleh kumpulan 15 jadual berkala untuk membentuk hidrida nitrogen, lebih dikenali sebagai ammonia (NH3).
N2 (g) +3 h2 (g) → 2 nh3 (g)
Reaksi memerlukan bekalan haba, tekanan tinggi dan kehadiran pemangkin (mereka mempercepat tindak balas kimia).
Hidror logam
Mereka dibentuk oleh reaksi logam peralihan (Kumpulan 3, 4, 5, 6, 10, 11 dan 12 dari jadual berkala) dengan hidrogen. Walau bagaimanapun, logam peralihan kumpulan 7, 8 dan 9 tidak membentuk sebatian dengan hidrogen, fenomena yang dikenali sebagai jurang hidrida atau jurang hidrida.
Ciri unik hidror logam peralihan adalah bahawa mereka tidak selalu membentangkan perkadaran tetap antara bilangan atom hidrogen dan bilangan atom yang ada dalam hidrida. Iaitu, formula dan struktur mereka tidak mudah diwakili.
Penggunaan/aplikasi hidros
 Hydros sangat terdapat di salah satu daripada pelbagai jenis bateri: seperti nimh. Sumber: Multicherry, CC BY-SA 4.0, melalui Wikimedia Commons
Hydros sangat terdapat di salah satu daripada pelbagai jenis bateri: seperti nimh. Sumber: Multicherry, CC BY-SA 4.0, melalui Wikimedia Commons Hidros terdapat dalam bateri hidrida logam nikel (NIMH), digunakan bersama dengan logam nadir bumi, kobalt atau mangan. Beberapa hidror logam telah diperiksa untuk digunakan dalam kereta elektrik yang didorong oleh sel berkaitan hidrogen.
Boleh melayani anda: Kaedah keseimbangan redoks: Langkah, contoh, latihanMengurangkan ejen
Lithium hydride dan natrium boron (NABH4) Mereka digunakan sebagai tindak balas kimia dalam tindak balas sintesis organik.
Penyimpanan hidrogen dan kegunaan lain yang berkaitan
Terdapat juruterbang penggunaan hidrogen sebagai bahan bakar dalam kenderaan bermotor, tetapi disebabkan oleh letupannya penggunaannya telah terhad sebagai bahan bakar. Penggunaan Hydros telah dicadangkan sebagai bentuk penyimpanan hidrogen, dengan itu mengawal bahaya mereka.
Di samping itu, hidror telah digunakan untuk pemurnian dan pemisahan sensor hidrogen dan suhu.
Desiccants
Kalsium hidrida digunakan untuk mengeluarkan air yang ada dalam pelarut organik.
Asid berasal dengan hidror molekul
Sebagai contoh: asid hidroklorik dibentuk oleh larutan dalam medium akueus klorin hidrida (HCl), menggunakan asid hidroklorik dalam penghapusan oksida yang menutupi besi, pengasidan telaga minyak, pengeluaran klorida kalsium dan mineral.
Baja
Ammonia (NH3) Ia adalah hidrida yang digunakan sebagai baja cecair dan berfungsi untuk sintesis sebatian dengan ammonium nitrat dan ammonium sulfat, yang digunakan sebagai baja.
Air
Adalah hidrida yang paling penting. Ia digunakan dalam banyak industri dengan kegunaan dan aplikasi yang berbeza. Air adalah yang bertanggungjawab utama untuk kewujudan makhluk hidup.
Contoh hidror
Akhirnya, contoh lain hidror akan disenaraikan dengan formula dan nama masing -masing:
SNH4: Tin Hydride | PH3: fosforus hidrida (fosfin) atau fosforus trihydride |
KH: Lead Hydride | Mgh2: magnesium hidrida atau magnesium dihydruro |
KH: Potassium Hydride | CH4: Carruro Carruro atau Karbon Tetrahydride (metana) |
CAH2: Kalsium hidrida | FEH2: Iron Hydride (II) |
NAH: Natrium hidrida | ZNH2: zink hidrida |
LIH: Lithium hidrida | Bah2: Barium Hydride |
CSH: Cesium Hydride | BH3: Boron Hydro (Bas |
Beh2: Beryl atau Beryl Dihydride Hydride | SIH4: Silicon Hydro (Silan) |
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wojes, Ryan. (27 Ogos 2020). Apa itu hidrida logam? Pulih dari: Thoughtco.com
- Elemen Amerika. (2020). Hydridides. Diperolehi daripada: Americanements.com
- Wikipedia. (2020). Hidrida. Diperoleh dari: dalam.Wikipedia.org
- Tandis Arani. (15 Ogos 2020). Hydridides. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Editor enyclopaedia Britannica. (2020). Hidrida. Pulih dari: Britannica.com