Struktur Magnesium Hydroxide, Properties, Nomenclature, Kegunaan

- 1629
- 329
- Anthony Breitenberg
Dia Magnesium hidroksida Ia adalah sebatian bukan organik yang formula kimia adalah mg (OH)2. Dalam bentuk murni ia adalah pepejal putih tanpa kecerahan dan penampilan amorf; Walau bagaimanapun, dengan kandungan kekotoran yang kecil dan tepat ia berubah menjadi brucita pepejal kristal, mineral yang berada dalam deposit tertentu, dan merupakan sumber magnesium yang kaya.
Ia adalah elektrolit atau asas yang lemah, jadi pemisahannya rendah di dalam air. Harta ini menjadikan mg (oh)2 neutralizer keasidan yang baik untuk penggunaan manusia; ubat terkenal sebagai penggantungan susu dari magnesia. Ia juga merupakan pengetuk api dengan melepaskan air semasa penguraian terma.
 Contoh hidroksida magnesium pepejal. Sumber: ChemicalInterest [Domain Awam]
Contoh hidroksida magnesium pepejal. Sumber: ChemicalInterest [Domain Awam] Di bahagian atas imej beberapa pepejal magnesium hidroksida ditunjukkan, di mana warna putih legapnya dapat dilihat. Semakin kristal mereka, mereka mengembangkan permukaan kaca dan mutiara.
Struktur kristalnya adalah pelik kerana ia menetapkan kristal heksagon dua kali ganda, yang menjanjikan reka bentuk untuk reka bentuk bahan baru. Dalam lapisan ini beban positif mereka memainkan peranan penting kerana penggantian mg2+ oleh kation trivalen, dan spesies yang terkurung di antara dinding yang terdiri daripada anion OH-.
Sebaliknya, aplikasi lain diperoleh bergantung kepada morfologi zarah atau nanopartikel yang disediakan; sebagai pemangkin atau penyerap. Dalam kesemuanya, nisbah 1: 2 untuk ion mg adalah malar2+: Oh-, dicerminkan dalam formula MG yang sama (OH)2.
[TOC]
Struktur
Formula dan Octaedro
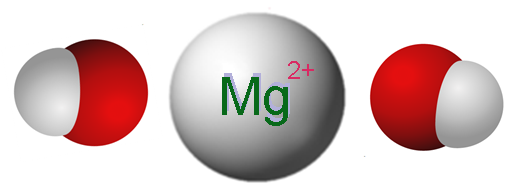 Ion yang membentuk magnesium hidroksida. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Ion yang membentuk magnesium hidroksida. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Imej unggul menunjukkan ion yang membentuk MG (OH)2. Seperti yang dapat dilihat, terdapat dua anion oh- Untuk setiap kation mg2+, yang berinteraksi secara elektrostatik untuk menentukan kristal struktur heksagon. Formula yang sama menunjukkan bahawa nisbah mg: oh ialah 1: 2.
Walau bagaimanapun, struktur kristal yang benar sedikit lebih rumit daripada menganggap ion mg sederhana2+ Dan oh-. Sebenarnya, magnesium dicirikan dengan mempunyai nombor koordinasi 6, jadi ia dapat berinteraksi dengan sehingga enam oh-.
Oleh itu, Octahedron Mg (OH) terbentuk6, di mana atom oksigen jelas berasal dari oh-; dan struktur kristal kini terletak pada pertimbangan octahedra seperti itu dan bagaimana mereka berinteraksi antara satu sama lain.
Malah, unit MG (OH)6 Mereka akhirnya menentukan struktur dua pelapis yang, seterusnya, diperintahkan di ruang angkasa untuk menyebabkan kaca heksagon.
Boleh melayani anda: berat atomDua lapisan
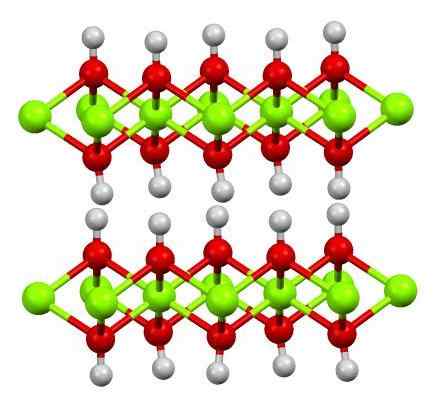 Lapisan dua hidroksida magnesium. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Lapisan dua hidroksida magnesium. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Imej atas menunjukkan lapisan ganda magnesium hidroksida (LDH) Hidroksida double berlapis). Sfera hijau mewakili ion mg2+, yang boleh digantikan oleh orang lain yang mempunyai beban yang lebih besar untuk menghasilkan beban positif di lapisan.
Perhatikan bahawa di sekitar setiap mg2+ Terdapat enam sfera merah yang disambungkan ke sfera putih masing -masing; iaitu, unit octahedral mg (oh)6. Oh- Ia bertindak sebagai jambatan untuk menyertai dua mg2+ pesawat yang berbeza, yang menjadikan lapisan itu dikurung.
Begitu juga, diperhatikan bahawa atom hidrogen menunjuk ke atas dan ke bawah, dan merupakan yang pertama bertanggungjawab untuk daya intermolecular untuk mengekalkan kedua -dua lapisan mg (OH) bersama -sama6.
Di antara lapisan ini, molekul neutral (seperti alkohol, ammonia dan nitrogen) atau bahkan anion, bergantung pada bagaimana positifnya (jika ada ion3+ atau iman3+ Menggantikan MG2+). "Pengisian" spesies ini dikurung oleh permukaan yang terdiri daripada anion OH-.
Morfologi
Kaca heksagon dan berganda tumbuh perlahan atau cepat. Semuanya bergantung kepada parameter sintesis atau penyediaan: suhu, hubungan molar, pergolakan, pelarut, reagen sebagai sumber magnesium, pangkalan atau agen precipitating, dll. Apabila kaca tumbuh, tentukan mikrostruktur atau morfologi nanopartikel atau agregatnya.
Oleh itu, nanopartikel ini boleh mempunyai hidangan, platelet, atau kembang kol. Begitu juga, pengedaran saiznya boleh berubah, serta tahap keliangan pepejal yang dihasilkan.
Sifat
Penampilan fizikal
Ia adalah pepejal putih, berbulu atau serbuk, dan tandas.
Jisim molar
58,3197 g/mol.
Ketumpatan
3.47 g/ml.
Takat lebur
350 ºC. Pada suhu ini ia rosak di dalam oksida dengan melepaskan molekul air yang terkandung dalam kristal mereka:
Mg (oh)2(s) => mgo (s) +h2O (g)
Kelarutan air
0.004 g/100 ml pada 100 ° C; Iaitu, ia hampir tidak dapat dibubarkan dalam air mendidih, jadi ia adalah sebatian yang tidak larut di dalam air. Walau bagaimanapun, dengan mengurangkan pH (atau peningkatan keasidan) kelarutannya meningkat dengan pembentukan acuo kompleks, mg (OH2)6.
Sebaliknya, jika mg (oh)2 telah menyerap co2, akan melepaskan gas yang dikekalkan sebagai effervescence ketika melarutkan dalam medium berasid.
Boleh melayani anda: helium: sejarah, sifat, struktur, risiko, kegunaanIndeks refraktif
1,559
Ph
Penggantungan berair mempunyai pH yang berbeza antara 9.5 dan 10.5. Walaupun nilai -nilai ini adalah normal, ia mencerminkan asasnya sedikit terhadap hidroksida logam lain (seperti NaOH).
Kapasiti haba
77.03 J/mol · k
Di mana ia berada?
 Blue Blue Blue Blut. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Blue Blue Blue Blut. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Magnesium hidroksida boleh didapati dalam alam semula jadi sebagai mineral brucita, yang dicirikan oleh warna putih telus, dengan nada hijau atau kebiruan bergantung pada kekotorannya. Begitu juga, brucita adalah sebahagian daripada beberapa tanah liat, seperti klorit, ketika melayang di antara lapisan silicates, disertai oleh ion logam.
Di La Brucita terdapat ion lain selain mg2+, seperti al3+, Iman3+, Zn2+ dan Mn2+. Menas mereka boleh didapati di kawasan yang berbeza atau tasik di Scotland, Kanada, Itali dan Amerika Syarikat.
Secara fizikal mereka melihat.
Mineral ini adalah salah satu kejahatan yang mempengaruhi simen dan konkrit, kerana ia cenderung berkembang dan menyebabkan patah tulang di dalamnya. Walau bagaimanapun, ia tidak menyerap co2, Oleh itu, penalaannya tidak menyumbang kepada kesan rumah hijau dan, oleh itu, ia adalah sumber mineralogi yang sesuai (dan yang terkaya) untuk mendapatkan magnesium, sebagai tambahan kepada air laut.
Nomenclature
Mg (oh)2 Ia mempunyai sehingga tiga nama yang diterima oleh IUPAC (daripada mineralogi atau ubat). Ini sangat serupa antara satu sama lain, kerana sama seperti cara mereka berakhir.
Sebagai contoh, 'magnesium hidroksida' sepadan dengan namanya mengikut tatanama stok, meninggalkan (ii) pada akhirnya kerana +2 hampir secara lalai satu -satunya keadaan pengoksidaan magnesium.
'Magnesium dihydroxide', menunjuk dengan awalan pengangka Yunani bilangan ion oh- ditunjukkan dalam formula mengikut tatanama sistematik. Dan 'hidroksida magnet', berakhir dengan akhiran -ico sebagai keadaan maksimum dan "unik" pengoksidaan magnesium, menurut tatanama tradisional.
Nama -nama lain, seperti susu brucita atau magnesia, walaupun mereka secara langsung berkaitan dengan kompaun ini, ia tidak mudah untuk merujuknya ketika datang ke pepejal yang paling murni, atau sebagai sebatian tak organik (reagen, bahan mentah, dan lain -lain.).
Aplikasi
Neutralizer
Mg (oh)2 Oleh kerana kelarutan yang rendah di dalam air hakikat bahawa ia adalah neutralizer keasidan yang sangat baik; Jika tidak, medium akan mendasarkan apabila menyumbang kepekatan besar ion OH-, Seperti pangkalan lain (elektrolit yang kuat).
Boleh melayani anda: hibrida kimiaOleh itu, mg (oh)2 Hampir tidak melepaskan OH-, Pada masa yang sama ia bertindak balas dengan ion h3Sama ada+ Untuk membentuk kompleks magnesium, juga disebutkan di atas. Mampu meneutralkan keasidan media berair, ditakdirkan untuk rawatan air kumbahan.
Ia juga merupakan bahan tambahan makanan, baja, dan produk kebersihan peribadi tertentu, seperti ubat gigi, kerana keasidannya berkurangan.
Antacid
Menjadi sedikit larut air, ia boleh diambil tanpa menjalankan risiko kesan ion OH- (sangat sedikit pemisahan seperti elektrolit yang lemah).
Ciri ini, yang dikaitkan dengan subpart dari atas, menjadikannya antacid untuk merawat keasidan perut, penyakit gastrousus, senak dan sembelit, yang dijual di bawah formula susu magnesia.
Sebaliknya, susu magnesia juga membantu memerangi fasa yang menjengkelkan (luka putih dan merah yang muncul di dalam mulut).
Retardant api
Di bahagian Properties, sebutkan dibuat bahawa MG (OH)2 Ia memecah melepaskan air. Tepatnya, air sedemikian membantu menghentikan kemajuan api, kerana mereka menyerap haba untuk menguap dan, pada gilirannya, wap mencairkan gas mudah terbakar atau mudah terbakar.
Mineral Brucita biasanya digunakan secara industri untuk tujuan ini, yang dimaksudkan sebagai pengisian bahan -bahan tertentu, seperti plastik polimer yang berlainan (PVC, resin, karet), kabel atau siling.
Pemangkin
Mg (oh)2 disintesis sebagai nanoplaquetas telah terbukti cekap untuk memangkinkan pengurangan kimia; Sebagai contoh, 4-nitrofenol (pH-no2) A 4-aminophenol (ph-nh2). Mereka juga mempunyai aktiviti antibakteria, jadi ia boleh digunakan sebagai ejen terapeutik.
Penyerap
Beberapa pepejal Mg (OH)2 Mereka boleh berliang, bergantung pada kaedah penyediaan mereka. Oleh itu, mereka mencari permohonan sebagai penyerap.
Dalam penyelesaian berair, mereka dapat menyerap (di permukaan mereka) molekul pewarna, menjelaskan air. Sebagai contoh, mereka dapat menyerap pewarna indigo carmine yang terdapat dalam arus air.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Magnesium hidroksida. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Magnesium hidroksida. Pangkalan data PUBCHEM. CID = 14791. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Galeri Amethyst. (2014). Brucite mineral. Pulih dari: galeri.com
- Henrist et al. (2003). Kajian morfologi nanopartikel magnesium hidroksida
- dicetuskan dalam larutan berair cair. Jurnal Pertumbuhan Kristal 249, 321-330.
- Saba J., Shanza R. K., Muhammad r. S. (2018). Sintesis dan analisis struktur nanopartikel magnesium hidroksida mesoporous sebagai pemangkin yang cekap.
- Thimmasandra Narayan Ramesh dan Vani Pavada Sreenivasa. (2015). Pembuangan pewarna karmin indigo dari larutan akueus menggunakan magnesium hidroksida sebagai penyerap. Jurnal Bahan, Vol. 2015, ID artikel 753057, 10 halaman. doi.org/10.1155/2015/753057
- « Sejarah nikel, sifat, struktur, kegunaan, risiko
- Carlos Pellicer Chamber Biografi, Gaya, Kerja, Frasa »

