Natrium hipoklorit (NaClo)
- 1455
- 66
- Mr. Tracy Parisian
Kami menerangkan apakah natrium hipoklorit, sifat, sintesis dan aplikasinya
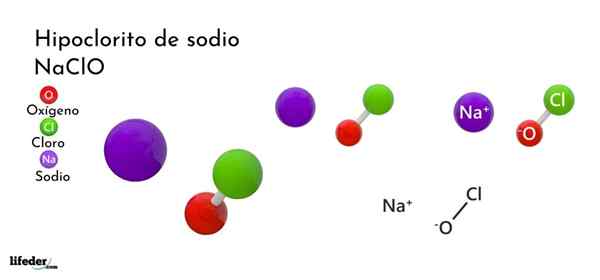
 Formula dan struktur natrium hipoklorit
Formula dan struktur natrium hipoklorit Apakah natrium hipoklorit?
Dia Natrium hipoklorit (NaClo) adalah garam natrium ternary dan tidak organik. Secara komersil ia dicapai sebagai penyelesaian berair dan merupakan ejen aktif produk domestik dan perindustrian ini. Penyelesaian ini dikenali dengan nama -nama klorin Whiter, Soda Whiter, Liquid Whiter atau, lebih halus, minuman keras.
Di dalam air, natrium hipoklorit mempamerkan sifat pengoksidaan yang sama klorin gas, jadi penyelesaian garam ini bersamaan dengan membawa sebatian di dalam botol plastik. Malah, klorin yang terdapat di dalam bekas ini adalah penunjuk kepekatan dan kuasa pemutihan larutan natrium hipoklorit.
Garam ternary ini di dalam air boleh dianggap sebagai larutan klorin berair yang mudah; Walau bagaimanapun, terdapat juga bentuk lain yang tersedia, seperti pepejal dalam kes kalsium hipoklorit, dan klorin cecair. Ketiga mempunyai kuasa pengoksidaan yang sama dan penggunaannya bergantung kepada pembolehubah seperti keselesaan, prestasi atau masa.
Formula
Formula kimia natrium hipoklorit adalah NaClo. Terdiri daripada kation+ Dan anion clo-. Ion na+ Mereka merasakan tarikan elektrostatik untuk ion CLO-, Yang terakhir mengamalkan struktur tetrahedral dengan hibridisasi SP3.
Formula menunjukkan perkadaran ion dalam keadaan anhidrida, yang sama dengan 1: 1. Walau bagaimanapun, ia hanya terpakai untuk anhydride.
Dalam kes hipoklorit natrium terhidrat -satu bentuk yang paling stabil untuk garam ini -formula kimia adalah NaClo · 5h2Sama ada.
Di mana natrium hipoklorit?
NaClo adalah produk sintetik dan, kerana kereaktifannya, hanya terdapat di kawasan tempatan di mana ia digunakan, terutamanya dalam air kumbahan, tanah atau bahkan dalam emanasi air minuman.
Di dalam badan manusia berlimpah ion klorida, yang boleh mengambil bahagian dalam tindak balas redoks yang menghasilkan hipoklorit natrium dalam organisma.
Boleh melayani anda: oksida logamSintesis
Sepanjang sejarah, NaClo telah disediakan untuk beberapa kaedah. Yang paling mudah terdiri daripada penyelesaian klorin dalam air, atau penyelesaian NA2Co3 Itu pelepasan co2 Dengan tindakan asid hipoklorus (HCLO).
Kaedah lain menggunakan air garam laut sebagai bahan mentah melalui proses elektrolitik. Di bawah pergolakan mekanikal yang cekap, CL2 dan NaOH yang dihasilkan oleh NaCl dan Air bertindak balas dan menjadi NaClo:
Cl2(g) + 2NAOH (aq) => NaClo + NaCl + H2O + q (panas)
Hari ini proses pelacur mengeluarkan kompaun ini ke skala besar, yang terdiri daripada versi yang lebih baik dari kaedah sebelumnya yang diterangkan.
Penggunaan/aplikasi natrium klorit
 Salah satu aplikasi utama hipoklorit natrium adalah untuk memakan pakaian
Salah satu aplikasi utama hipoklorit natrium adalah untuk memakan pakaian Aplikasi natrium hipoklorit yang paling biasa adalah:
- Natrium hipoklorit digunakan sebagai ejen pemutihan dalam tekstil, dalam detergen yang menggabungkannya dan dalam industri kertas.
- Penggunaannya sebagai ejen bakterisida dan disinfektan sangat luas, menggunakan pemurnian air dan rawatan air kumbahan.
- Kegunaannya dalam membasmi peralatan yang digunakan dalam penyediaan makanan dan pemprosesan buah -buahan dan sayur -sayuran diketahui. Ia juga digunakan dengan fungsi disinfektan yang sama dalam pengeluaran cendawan, lembu, babi dan ayam.
- Natrium hipoklorit digunakan dalam industri minyak di peringkat penapisan.
- Di rumah, kapasiti pemutihan natrium hipoklorit digunakan dalam mencuci pakaian putih, dan tindakan disinfektan dalam pembersihan mandi, lantai, dll.
- Natrium hipoklorit digunakan dalam terapi endodontik, khususnya dalam rawatan akar gigi. Rawatan ini menggunakan larutan dakin (klon hingga 0.5 %) yang mengekalkan tisu pergigian penting ketika membubarkan tisu nekrotik.
Sifat natrium hipoklorit
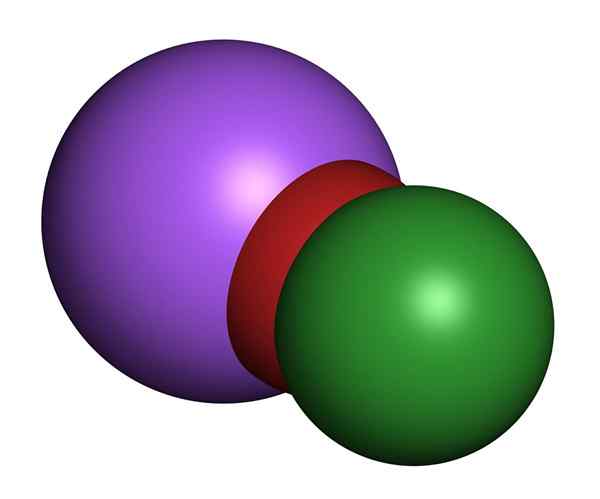 Model Hypochlorite Sodium 3D. Klorin (hijau), oksigen (merah), natrium (ungu)
Model Hypochlorite Sodium 3D. Klorin (hijau), oksigen (merah), natrium (ungu) Penyelesaian natrium hipoklorit pada suhu bilik tidak berwarna dan mempunyai bau klorin manis. Sifat fizikal berbeza -beza bergantung kepada kepekatan garam yang dibubarkan di dalam air. Semua mempunyai warna kuning.
Melalui teknik penghabluran, penyelesaian ini memperoleh NaClo pepejal · 5h2Atau, yang kristalnya berbayar hijau.
Garam terhidrat ini mempunyai berat molekul kira -kira 164 g/mol, ketumpatan 1.11 g/ml, sangat larut dalam air dan terurai hingga 101 ºC. NACLO · 5H2Atau juga sensitif terhadap reaksi anhidrida yang sama.
Mengapa garam pentahydrate? Oleh kerana NaClo mengkristal dalam persekitaran berairnya, molekul air membungkus ion dalam lingkungan berair.
Ia boleh difikirkan bahawa tiga molekul ini berinteraksi dengan pasangan elektron yang tidak diasingkan CL: bentuk jambatan hidrogen dengan O dan yang terakhir tertarik kepada NA.
Walau bagaimanapun, ia adalah kajian yang memberi tumpuan kepada struktur kristal pepejal ini yang mempunyai jawapan yang benar untuk soalan ini.
Keseimbangan berair
Anion CLO- Mengambil bahagian dalam keseimbangan hidrolisis berikut:
Hclo (ac) + h2Atau (l) clo-(Ac) + h+(Ac)
Jika keasidan penyelesaian meningkat, baki bergerak ke kiri, menghasilkan HCLO.
Asid ini lebih tidak stabil daripada hipoklorit dan, oleh itu, penguraian mengurangkan kepekatan ejen aktif. Sekiranya pH adalah asas (lebih besar daripada 11), ia menjamin kewujudan CLO- dan masa hayat produk.
Walau bagaimanapun, alkalinity yang berlebihan mencetuskan masalah lain dalam aplikasinya. Contohnya, penyelesaian naillo yang sangat asas merosakkan pakaian dan bukan hanya pelunturannya.
Juga, dalam medium berair HCLO juga berubah menjadi klorin, yang menerangkan pewarna kuning penyelesaian ini:
Boleh melayani anda: kepekatan peratusanHCLO (AC) CL2(g) + h2Atau (l)
Tidak seimbang
Atom klorin dalam natrium hipoklorit mempunyai keadaan pengoksidaan +1, hanya memerlukan dua elektron untuk melengkapkan oktet Valencia.
Sebaliknya, konfigurasi elektroniknya adalah [ne] 3s23p5, Mampu mengosongkan semua elektron orbital mereka "p", lebih banyak tenaga.
Ini mengakibatkan hipoklorit mengalami tindak balas tidak seimbang pada ion dengan keadaan pengoksidaan +1 dan +5:
3Cl-(Ac) 2cl-(ac) + clo3-(Ac)
Reaksi ini dalam larutan berair dipercepat dengan peningkatan suhu dan kepekatan hipoklorit. Begitu juga, tindak balas berterusan oleh mekanisme yang berbeza yang dipangkin oleh oksida cahaya dan logam tembaga, nikel dan kobalt:
2NaOCl (aq) => o2(g) + 2nacl (aq)
Namento anhydrid tidak seimbang dengan kelajuan yang lebih cepat, malah meletup.
Ejen pengoksidaan
Atom klorin dapat menerima elektron spesies negatif (nukleofilik). Anhydride adalah ejen pengoksidaan yang kuat, mengurangkan anion klorida (CL-).
Dalam kes NaClo · 5h2Atau, dianggap bahawa molekul air sebahagiannya menghalang CLO- Mereka mengalami serangan nukleofilik.
Walau bagaimanapun, memandangkan linearity struktur CLO-, Molekul air ini tidak melambatkan "serangan" yang cukup pada atom Cl. Oleh sebab itu, natrium hipoklorit adalah ejen pengoksidaan yang kuat.
Rujukan
- Wikipedia. (2018). Natrium hipoklorit. Diperoleh pada 7 April 2018, dari: dalam.Wikipedia.org
- Francisco J. Arnaiz. (2016). Eksperimen untuk makmal kimia bukan organik hijau. Jabatan Kimia, Universiti Burgos, Sepanyol.
- Buku Kimia. (2017). Natrium hipoklorit. Diperoleh pada 7 April 2018, dari: Buku Kimia.com
- Brian Clegg. (9 Mac 2016). Natrium hipoklorit. Diperoleh pada 7 April 2018, dari: Kimia World.com
- Oxychem. (Disember 2014). Buku Panduan Sodium Hypochlorite. Diperoleh pada 7 April 2018, dari: Oxy.com
- Pubchem. (2018). Natrium hipoklorit. Diperoleh pada 7 April 2018, dari: Pubchem.NCBI.NLM.NIH.Gov.

