Konsep Isotherms Adsorpsi, Jenis, Contoh

- 5015
- 1358
- Delbert Dare
The Isotherms penjerapan Mereka adalah perwakilan grafik tingkah laku zarah yang terserap, di permukaan pepejal atau cecair, apabila kepekatannya meningkat. Sekiranya zarah terserap sesuai dengan gas, maka tekanannya diambil kira.
Dengan memerhatikan isotherm ini, idea bagaimana proses penjerapan berlaku boleh diambil; Dan oleh itu, bagaimana interaksi permukaan zarah, dan ciri-ciri permukaan. Menganalisis isotherm disimpulkan jika permukaannya licin, berliang, atau microporous, serta pemeluwapan yang mungkin.
 Komponen yang diperlukan untuk graf atau pembinaan isotherms penjerapan. Sumber: Gabriel Bolívar.
Komponen yang diperlukan untuk graf atau pembinaan isotherms penjerapan. Sumber: Gabriel Bolívar. Imej unggul membantu menjelaskan yang disebutkan di atas. Zarah -zarah yang terserap (lingkaran ungu) adalah penyerap yang diserap. Sementara penyerap adalah yang mempunyai kawasan di mana penyerap akan diserap. Apabila tekanan atau kepekatan anda meningkat, semakin besar jumlah yang terserap ke atas penyerap.
Perwakilan mudah ini sepadan dengan penjerapan yang diterangkan oleh jenis i isotherm. Menggunakan isotherms, penjerapan gas atau infiniti cecair pada gel, pepejal atau pemangkin dipelajari.
[TOC]
Jenis isotherms penjerapan
 Isotherms penjerapan untuk sistem gas-pepejal. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Isotherms penjerapan untuk sistem gas-pepejal. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Lima isotherms eksperimen utama yang digunakan oleh S ditunjukkan di atas. Brunauer untuk mengklasifikasikan zarah gas pada pepejal. Masing -masing menerangkan proses penjerapan yang berbeza. Juga, masing -masing mempunyai model matematik yang berusaha untuk menyimpulkan kelakuan lengkungnya.
Tidak ada unit atau pembolehubah yang digunakan dalam paksi x (p/po) dan y (x), paksi x menunjukkan berapa banyak tekanan atau penukaran adsorbate "bertindak" pada pepejal; Walaupun paksi y, mengatakan berapa banyak penyerap itu benar -benar terserap di permukaan pepejal atau penyerap tersebut.
Ia boleh melayani anda: tembaga sulfat (cuso4): struktur, sifat, mendapatkan, menggunakanOleh itu, ketika kita bergerak ke kanan paksi x, kita melihat bagaimana jumlah zarah yang terserap meningkat bergantung pada peningkatan tekanan atau kepekatan mereka. Ini membawa kepada maksimum, kerosakan, lembah, dll., entah bagaimana atau yang lain membolehkan mentafsirkan bagaimana penjerapan berlaku.
Taipkan isotherm
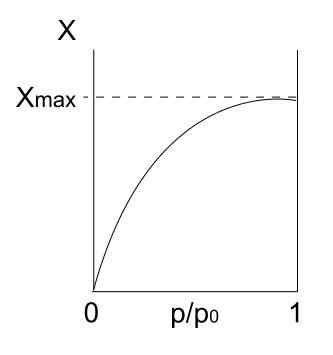 Taipkan isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Taipkan isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Kami mempunyai jenis i isoterm di atas, yang juga dikenali sebagai isotherm Langmuir, kerana modelnya meramalkan bentuk lengkung ini. Melihatnya, segera ditafsirkan bahawa terdapat jumlah maksimum (xmax) zarah yang terserap, yang tidak akan berubah tidak kira berapa tekanan meningkat.
Nilai penjerapan maksimum ini mungkin disebabkan oleh beberapa sebab. Salah satu daripada mereka adalah bahawa kimia sedang berlaku, yang bermaksud bahawa zarah atau penyerap terikat dengan kuat ke permukaan pepejal atau penyerap. Sekali tidak ada ruang di permukaan untuk menampung lebih banyak zarah, tidak akan ada penjerapan.
Kemudian dikatakan bahawa monolayer telah terbentuk (seperti lingkaran ungu imej pertama).
Sebab lain untuk membenarkan jenis i isotherm adalah bahawa fisisorption berlaku, yang bermaksud bahawa interaksi permukaan zarah sangat lemah (mereka tidak menyiratkan pembentukan ikatan kimia).
Dalam kes ini, zarah -zarah akhirnya memasuki microporos, yang pernah diisi, permukaan tidak akan mempunyai lebih banyak tempat untuk proses yang berikut; Iaitu, ia mempunyai sedikit kawasan luaran yang tersedia (seolah -olah ia adalah kekisi yang sangat halus). Tingkah laku ini diperhatikan apabila serbuk mikroporus dianalisis.
Boleh melayani anda: silikon: sejarah, sifat, struktur, mendapatkan, kegunaanJenis isotherm Ii
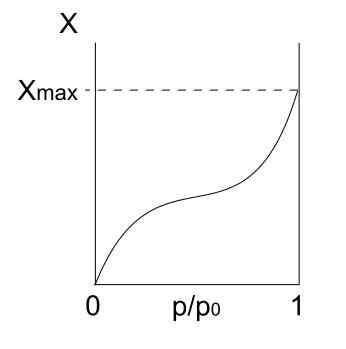 Isotherm jenis II. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Isotherm jenis II. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Up kita mempunyai isotherm jenis II, juga dikenali sebagai isotherm sigmoid. Ini menerangkan proses physis untuk kedua -dua pepejal dan pepejal makroporus.
Perhatikan bahawa pada mulanya ia menyerupai isotherm sebelumnya, yang bermaksud bahawa zarah -zarah yang terserap membentuk monolayer di permukaan penjerap. Sebaik sahaja monolayer siap, zarah -zarah lain akan diserap di atas bekas, yang menimbulkan multilayers. Ini adalah ketika kita melihat peningkatan ciri isotherm ini (betul).
Sebab lain mengapa isotherm jenis II diperolehi adalah kerana zarah -zarah merasakan pertalian yang lebih besar untuk permukaan daripada diri mereka. Iaitu, monolayer (zarah-superficie) akan lebih stabil dan tahan lama daripada multilayers (zarah-zarah) kemudian.
Jenis isotherm Iii
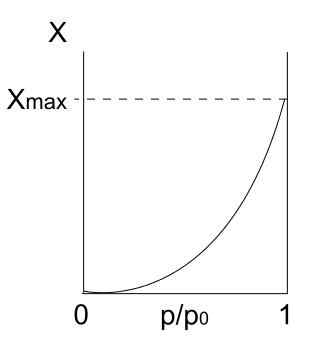 Jenis III isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Jenis III isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Isotherm jenis III adalah serupa dengan jenis II berkaitan dengan tafsirannya: Multicapas dan Physis. Walau bagaimanapun, kali ini interaksi antara multicapas lebih kuat daripada monolayer dengan permukaan pepejal. Oleh itu, ia adalah penjerapan yang tidak teratur, dengan gundukan zarah terserap dan bahagian permukaan bebas.
Jenis isotherm Iv
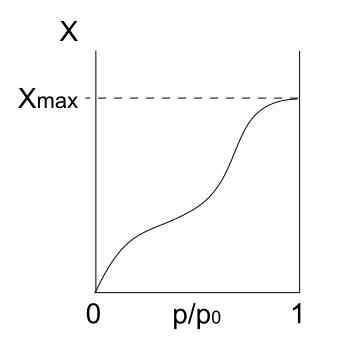 Jenis IV isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Jenis IV isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Isotherm jenis IV juga menerangkan proses fisisorption dan multilayer, kelihatan seperti isotherm jenis II; Tetapi sekarang, dalam pepejal pepejal (dan mesoporus), di mana pemeluwapan zarah gas adalah mungkin dalam jumlah cecair kecil. Sehingga liang dengan cecair "dilindungi", monolayer tidak akan lengkap.
Boleh melayani anda: Kimia Makanan: Bidang Pengajian, Elemen, AplikasiJenis isotherm V
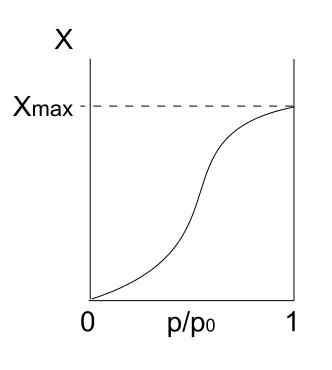 Jenis V isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0)
Jenis V isotherm. Sumber: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) Jenis V isotherm adalah serupa dengan jenis IV, hanya kali ini pembentukan multicapas lebih mudah daripada mono forpa masing -masing. Iaitu, ia menyerupai penjerapan yang diterangkan oleh isotherm jenis III. Di sini multicapa mencapai ketebalan maksimum, di mana tidak ada tempat untuk lebih banyak zarah untuk menyerap.
Contoh
Beberapa contoh sistem pepejal gas akan disebutkan di bawah di sebelah jenis isotherms yang telah diperolehi dalam kajian eksperimen mereka:
-Ammonia-karbon (Jenis I)
-Nitrogen-Zeolites (Jenis I)
-Hidrogen-karbon pada suhu tinggi (jenis I)
-Oxygen-negro arang batu (Jenis I)
-Nitrogen Silika (Jenis II)
-Nitrogen-Hierro (Jenis II)
-Silika bromo-gel (jenis III)
-Wap iodin silika (Jenis III)
-Nitrogen-politik (Jenis III)
-Kripton-negro arang batu (Jenis IV)
-Benzene-gel ferric oxide (Jenis IV)
-Air Wap-Karbon (Jenis V)
Perhatikan bahawa pepejal yang disebutkan adalah arang batu, arang batu hitam, besi logam, oksida besi, zeolit dan gel silika. Semuanya adalah contoh penyerap yang baik dengan pelbagai aplikasi perindustrian.
Rujukan
- Walter J. Moore. (1963). Kimia Fizikal. Dalam termodinamik dan keseimbangan kimia. (Keempat ed.). Longmans.
- Iran. Levine. (2009). Prinsip Fizikokimia. Edisi Keenam, halaman 479-540. MC Graw Hill.
- Glasstone. (1970). Buku teks kimia fizikal. Edisi kedua. D. Van Nostrand, Syarikat, Inc.
- Unit 3. Fenomena permukaan. (s.F.). Penjerapan. [Pdf]. Pulih dari: DEPA.Fquim.Unam.mx
- Lowell s., Shields J.Dan. (1984) Isotherms penjerapan. Dalam: kawasan permukaan serbuk dan keliangan. Springer, Dordrecht.
- Elsevier b.V. (2020). Isotherm penjerapan. Scientedirect. Diperoleh dari: Scientedirect.com
- Wikipedia. (2020). Penjerapan. Diperoleh dari: dalam.Wikipedia.org

