Struktur dan fungsi lactoferrin
- 3207
- 937
- Clarence Greenholt DDS
The Lactoferrin, Juga dikenali sebagai apolactoferrin atau lactotransferrin, ia adalah glikoprotein yang dihasilkan oleh banyak spesies mamalia yang mempunyai keupayaan untuk menyertai dan memindahkan ion besi (Fe3+). Ia berada dalam banyak cecair badan dan berkaitan dengan protein plasma pengikatan besi yang dikenali sebagai "transferrin".
Ia diasingkan pada tahun 1939 oleh Sorensen dan Sorensen dari susu lembu dan, hampir 30 tahun kemudian, pada tahun 1960, Johannson menentukan kehadirannya dalam susu manusia (namanya berasal dari klasifikasi sebagai protein kesatuan besi yang paling banyak dari susu besi yang paling banyak).
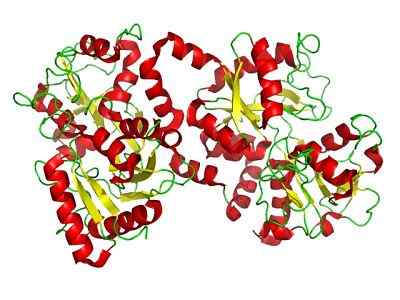
 Struktur Lactoferrin (Sumber: Liejealso [Domain Awam] melalui Wikimedia Commons)
Struktur Lactoferrin (Sumber: Liejealso [Domain Awam] melalui Wikimedia Commons) Penyiasatan berikutnya mengenal pasti lactoferrin dalam rembesan lain kelenjar exocrine seperti hempedu, jus pankreas dan rembesan usus kecil, serta di granul sekunder neutrofil, sel -sel plasma milik sistem imun.
Protein ini juga terdapat dalam air mata, air liur, air mani, cecair vagina, rembesan bronkial dan hidung dan air kencing, walaupun ia sangat banyak dalam susu (ia adalah protein kedua dalam kepekatan yang lebih besar selepas kasein) dan calcoster.
Walaupun pada mulanya dianggap hanya sebagai protein dengan aktiviti bakterostatik susu, ia adalah protein dengan pelbagai fungsi biologi, walaupun tidak semua ada kaitan dengan kapasiti pemindahan ion besi mereka.
[TOC]
Struktur Lactoferrin
Lactoferrin, seperti yang disebutkan. Ia adalah protein asas, dimuat secara positif dan dengan titik isoelektrik antara 8 dan 8.5.
Lobus n dan lobus c
Ia dibentuk oleh rantaian polipeptida tunggal yang dilipat untuk membentuk dua lobus simetri yang dipanggil lobus N (1-332 sisa) dan lobus c (344-703 sisa yang berkongsi antara 33 dan 41% homologi antara mereka sendiri.
Boleh melayani anda: lipoproteinKedua-dua lobus N dan Lobe C dibentuk oleh lembaran β dan kipas alfa, yang membentuk dua domain oleh lobus, domain I dan domain II (C1, C2, N1 dan N2).
Kedua -dua lobus disambungkan melalui rantau "engsel" yang terdiri daripada kipas alfa antara sisa 333 dan 343, yang memberikan fleksibiliti molekul yang lebih besar kepada protein.
Analisis urutan asid amino protein ini mendedahkan sejumlah besar tapak berpotensi untuk glikosilasi. Tahap glikosilasi sangat berubah -ubah dan menentukan rintangan terhadap aktiviti protease atau pH yang sangat rendah. Sakarida yang paling biasa di bahagian karbohidratnya adalah tangan, dengan lebih kurang 3% gula heksous dan 1% daripada heksosamin.
Setiap lobulus lactoferrin dapat beralih kepada dua ion logam, sama ada besi (Fe2+, Fe3+), tembaga (Cu2+), zink (Zn2+), kobalt (CO3+) atau mangan (Mn2+).
Molekul lain
Ia juga boleh menyertai, walaupun dengan kurang pertalian, molekul lain seperti lipopolysaccharides, glycosaminoglycans, DNA dan heparin.
Apabila protein dikaitkan dengan dua ion besi dikenali sebagai hollactoferrin, manakala ketika ia berada dalam bentuk "bebas", ia dipanggil apolctoferrin dan ketika ia hanya dikaitkan dengan atom besi dikenali sebagai lactoferrin tunggal -pharly lactoferrin.
Apolactoferrin mempunyai penyesuaian terbuka, sementara itu hololactoferrin mempunyai konfigurasi tertutup, jadi lebih tahan proteolisis.
Bentuk lactoferrin lain
Beberapa penulis menggambarkan kewujudan tiga isoforms lactoferrin: α, β dan γ. Bentuk lactoferrin-α dilambangkan seperti itu dengan keupayaan untuk bersatu dengan besi dan tanpa aktiviti ribonuclease. Bentuk lactoferrin -β dan lactoferrin -γ mempunyai aktiviti ribonuclease, tetapi mereka tidak dapat menyertai ion logam.
Fungsi
Lactoferrin adalah glikoprotein dengan pertalian untuk kesatuan besi jauh lebih tinggi daripada transferrin, protein penghantar besi dalam plasma darah, yang memberikan keupayaan untuk menyertai ion logam ini dalam pelbagai pH.
Boleh melayani anda: pengasingan geografiMemandangkan hakikat bahawa ia mempunyai beban bersih positif dan diedarkan dalam pelbagai tisu, ia adalah protein pelbagai fungsi yang terlibat dalam pelbagai fungsi fisiologi seperti:
- Peraturan penyerapan besi usus
- Proses tindak balas imun
- Mekanisme antioksidan badan
- Ia bertindak sebagai agen anticinogenic dan anti -radang
- Dia adalah ejen pelindung terhadap jangkitan mikroba
- Berfungsi sebagai faktor transkripsi
- Terlibat dalam perencatan protease
- Ia adalah protein antivirus, antijamur dan antiparasit
- Ia juga berfungsi sebagai proko dan mempunyai aktiviti ribonuclease
- Ia adalah faktor pertumbuhan tulang.
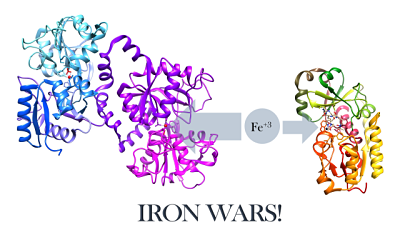 Perwakilan struktur lactoferrin dan siderophore E. Coli (sumber: w.Henley [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Perwakilan struktur lactoferrin dan siderophore E. Coli (sumber: w.Henley [CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Mengenai pertempuran jangkitan mikrob, lactoferrin bertindak dalam dua cara:
- Besi penculikan di tapak jangkitan (yang menyebabkan kekurangan pemakanan dalam mikroorganisma berjangkit, bertindak sebagai bakterostatik) atau
- Berinteraksi secara langsung dengan ejen berjangkit, yang boleh menyebabkan lisis sel.
Penggunaan farmakologi
Lactoferrin boleh didapati secara langsung apabila disucikan dari susu lembu, tetapi sistem moden lain didasarkan pada pengeluarannya sebagai protein rekombinan dalam organisma yang berbeza pertumbuhan yang mudah, cepat dan ekonomik.
Sebagai sebatian aktif beberapa ubat, protein ini digunakan untuk rawatan perut dan ulser usus, serta cirit -birit dan hepatitis C.
Ia digunakan terhadap jangkitan asal bakteria dan virus dan, di samping itu, ia digunakan sebagai sistem imun yang merangsang untuk pencegahan beberapa patologi seperti kanser.
Sumber lactoferrin di dalam badan manusia
Ekspresi protein ini pada mulanya dapat dikesan pada peringkat dua dan empat sel perkembangan embrio dan kemudian di peringkat blastocyst, sehingga saat pelaksanaan.
Boleh melayani anda: mikroevolusiIa kemudiannya dibuktikan dalam neutrofil dan sel epitel sistem pencernaan dan pembiakan dalam pembentukan.
Sintesis protein ini dijalankan dalam epithelia myeloid dan penyembur. Pada manusia dewasa, tahap tertinggi ekspresi lactoferrin dikesan dalam susu ibu dan calcoster.
Ia juga boleh didapati dalam banyak rembesan mukus seperti cecair rahim, seminal dan vagina, dalam air liur, hempedu, jus pankreas, rembesan usus nipis, hidung dan air mata. Telah ditentukan bahawa tahap perubahan protein ini semasa kehamilan dan semasa kitaran haid wanita.
Pada tahun 2000, pengeluaran lactoferrin di buah pinggang ditentukan, di mana ia dinyatakan dan dirembeskan melalui tiub pengumpulan dan boleh diserap semula di bahagian distal mereka.
Kebanyakan lactoferrin plasma pada manusia dewasa berasal dari neutrofil, di mana ia disimpan dalam granul sekunder tertentu dan granul tertiari (walaupun dalam kepekatan yang lebih rendah).
Rujukan
- Adlerva, l., Bartoskova, a., & Faldyna, m. (2008). Lactoferrin: ulasan. Perubatan Veteran, 53 (9), 457-468.
- Berlutti, f., Pantanella, f., Natalizi, t., Frioni, a., Paesano, r., Polimeni, a., & Valenti, p. (2011). Sifat antiviral lactoferrin-molekul imuniti semulajadi. Molekul, 16 (8), 6992-7018.
- Brock, j. (Sembilan-belas sembilan puluh lima). Lactoferrin: protein immunoregulatory pelbagai fungsi? Imunologi Hari Ini, 16 (9), 417-419.
- Brock, j. H. (2002). Fisiologi lactoferrin. Biokimia dan Biologi Sel, 80 (1), 1-6.
- González-Chávez, s. Ke., Arévalo-Gallegos, s., & Rascón-Cruz, Q. (2009). Lactoferrin: Struktur, Fungsi dan Aplikasi. Jurnal Antarabangsa Ejen Antimikrob, 33 (4), 301-E1.
- Alicay, ms. F., & Viljoen, m. (Sembilan-belas sembilan puluh lima). Lactoferrin: Kajian Umum. Haematologica, 80 (3), 252-267.
- Naot, d., Kelabu, a., Reid, i. R., & Cornish, J. (2005). Lactoferrin-faktor pertumbuhan tulang novel. Perubatan & Penyelidikan Klinikal, 3 (2), 93-101.
- Sanchez, l., Calvo, m., & Brock, J. H. (1992). Peranan biologi lactoferrin. Arkib Penyakit pada Kanak -kanak, 67 (5), 657.
- « Ciri -ciri replikasi virus, kitaran replikasi virus, contoh (HIV)
- Struktur, sifat, kegunaan etidium bromida etidium »

