Fungsi LDH, Penentuan, Reaksi, Nilai Normal
- 2716
- 674
- Kerry Schmitt
The Laktat dehidrogenase, Dehidrogenase asid laktik, laktat NAD-bergantung kepada laktat atau hanya LDH, adalah enzim milik kumpulan oksidortikas yang ditemui secara praktikal di semua tisu haiwan, sayur-sayuran dan banyak mikroorganisma seperti bakteria, ragi dan lengkungan.
Enzim jenis ini dilambangkan dengan nombor EC 1.1.1.27 Jawatankuasa Nomenclature Enzymatic dan bertanggungjawab terhadap tindak balas yang menukarkan laktat kepada piruvat (oleh pengoksidaan) dan sebaliknya (oleh pengurangan), pengoksidaan atau mengurangkan dyucleotides adenine nicotinamide (NAD+ dan NADH).
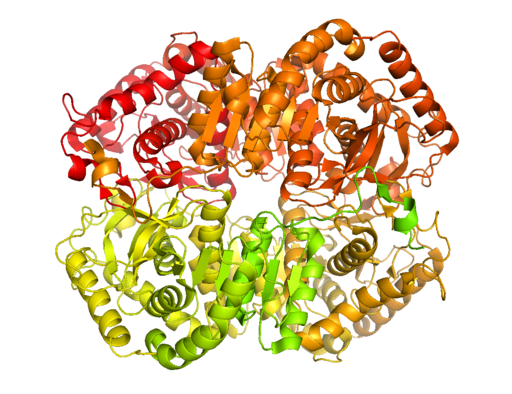
 Struktur kristal laktat dehidrogenase B (sumber: bcdoye [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] melalui Wikimedia Commons)
Struktur kristal laktat dehidrogenase B (sumber: bcdoye [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] melalui Wikimedia Commons) Tidak seperti penapaian alkohol, yang hanya berlaku dalam beberapa mikroorganisma seperti ragi dan penggunaan.
Enzim penting ini untuk metabolisme sel telah dikristalisasi dari otot tikus rangka pada tahun 1940 -an dan, setakat ini, yang terbaik dicirikan ialah otot rangka dan tisu jantung pada mamalia.
Dalam haiwan "unggul" enzim menggunakan isomer laktat (l-laktat) untuk pengeluaran piruvat, tetapi beberapa haiwan dan bakteria yang lebih rendah menghasilkan d-laktat dari piruvat yang diperolehi oleh glikolisis.
Dehidrogenase laktat biasanya dinyatakan kebanyakannya dalam tisu atau sel di bawah keadaan anaerobik (pengairan darah rendah) yang, pada manusia, misalnya, dapat mencirikan keadaan patologi seperti kanser, hati atau keadaan jantung.
Walau bagaimanapun, penukaran piruvat ke dalam laktat adalah tipikal otot semasa latihan dan kornea mata, yang kurang oksigen.
[TOC]
Fungsi
Dehydrogenase Laktat memenuhi pelbagai fungsi di banyak laluan metabolik. Ia adalah pusat keseimbangan antara laluan karbohidrat dan anabolik karbohidrat.
Semasa glikolisis aerobik, piruvat (produk terakhir laluan per se) Ia boleh digunakan sebagai substrat dehidrogenase piruvat kompleks enzimatik, dengan siapa ia adalah decarboxylated, membebaskan molekul asetil-CoA yang digunakan di hiliran, metabolik, dalam kitaran Krebs, dalam kitaran Krebs, dalam kitaran Krebs, dalam kitaran Krebs.
Dalam glikolisis anaerobik, sebaliknya, langkah terakhir glikolisis menghasilkan piruvat, tetapi ini digunakan oleh dehidrogenase laktat untuk menghasilkan laktat dan NAD+, yang mengembalikan NAD+ yang digunakan semasa tindak balas yang dikatalisis oleh gliseraldehid 3-fosfat dehidrogenase.
Seperti semasa anaerobiosis sumber utama pengeluaran tenaga dalam bentuk ATP adalah glikolisis, laktat dehidrogenase mempunyai peranan asas dalam reoksidasi NADH yang dihasilkan dalam langkah -langkah sebelumnya laluan glikolitik, penting untuk operasi enzim lain yang berkaitan.
Boleh melayani anda: tubulinLaktat dehidrogenase juga terlibat dalam glikogenesis yang berlaku dalam tisu yang menukar laktat menjadi glikogen dan, dalam beberapa tisu aerobik seperti jantung, laktat adalah bahan bakar yang dihasilkan semula untuk menghasilkan tenaga dan mengurangkan kuasa dalam bentuk ATP dan NAD+, masing -masing.
Ciri -ciri dan struktur
Terdapat pelbagai bentuk molekul laktat dehidrogenase. Hanya pada haiwan yang telah ditentukan bahawa terdapat lima aktiviti dehidrogenase laktat, semua tetramerik dan pada dasarnya terdiri daripada dua jenis rantai polipeptida yang dikenali sebagai subunities H dan M (dapat menjadi homo- atau heterotramérica).
Bentuk H biasanya dalam kain jantung, sementara bentuk m telah dikesan dalam otot rangka. Kedua -dua rantai berbeza antara satu sama lain dari segi kelimpahan, komposisi asid amino, sifat kinetik dan sifat struktur.
Borang H dan M adalah produk translasi gen yang berbeza, mungkin terletak dalam kromosom yang berbeza, dan juga di bawah kawalan atau peraturan gen yang berbeza. Bentuk H adalah utama dalam tisu dengan metabolisme aerobik dan bentuk m dalam tisu anaerobik.
Satu lagi jenis nomenclature menggunakan huruf A, B dan C untuk pelbagai jenis enzim di kedua -dua mamalia dan burung. Oleh itu, dehidrogenase otot laktat dikenali sebagai4, Jantung sebagai b4 dan yang ketiga dipanggil c4, yang khusus untuk buah zakar.
Ekspresi isoenzim ini dikawal baik dalam bentuk yang bergantung kepada pembangunan dan bergantung tisu.
Enzim telah diasingkan dari sumber haiwan yang berbeza dan telah ditentukan bahawa struktur tetrameriknya mempunyai berat molekul purata kira -kira 140 kDa dan tapak kesatuan untuk NADH atau NAD+ Ia terdiri daripada lembaran β yang terdiri daripada enam rantai dan 4 kipas alfa.
Keazaman
Oleh spektrofotometri
Aktiviti laktat dehidrogenase asal haiwan adalah spektrofotometrik tertentu In vitro melalui pengukuran perubahan pewarnaan terima kasih kepada proses oksidora yang berlaku semasa reaksi penukaran piruvat laktat.
Pengukuran dibuat pada 340nm dengan spektrofotometer dan kadar penurunan ketumpatan optik akibat pengoksidaan atau "kehilangan" NADH ditentukan, yang ditukar kepada NAD+.
Iaitu, tindak balas yang ditentukan adalah seperti berikut:
Pyruvate + nadh + h+ → laktat + nad+
Pengukuran enzimatik harus dijalankan dalam keadaan pH yang optimum dan kepekatan substrat untuk enzim, sehingga risiko meremehkan jumlah yang ada dalam sampel yang disebabkan oleh defisit substrat atau oleh keadaan yang melampau keasidan atau asas tidak berjalan.
Oleh imunohistokimia
Kaedah lain, mungkin agak lebih moden, untuk penentuan kehadiran dehidrogenase laktat mempunyai kaitan dengan penggunaan alat imunologi, iaitu, dengan penggunaan antibodi.
Boleh melayani anda: homologi (biologi)Kaedah ini memanfaatkan pertalian antara kesatuan antigen dengan antibodi yang dihasilkan secara khusus terhadapnya dan sangat berguna untuk penentuan pesat kehadiran atau ketiadaan enzim seperti LDH dalam kain tertentu.
Bergantung pada tujuan, antibodi yang digunakan mestilah khusus untuk mengesan mana -mana isoenzim atau untuk sebarang protein dengan dehidrogenase aktiviti laktat.
Mengapa menentukan dehidrogenase laktat?
Penentuan enzim ini dilakukan dengan tujuan yang berbeza, tetapi terutamanya untuk diagnosis klinikal beberapa keadaan, termasuk infark miokard dan kanser.
Di peringkat selular, pembebasan dehidrogenase laktat telah dianggap sebagai salah satu parameter untuk menentukan kejadian proses nekrotik atau apoptotik, kerana membran plasma menjadi telap.
Produk reaksi yang boleh ditentukan oleh Catalyz dalam kain untuk menentukan sama ada metabolisme anaerobik mendominasi beberapa sebab khas.
Tindak balas
Seperti yang pada mulanya mengulas, enzim laktat dehidrogenase, yang nama sistematiknya (S) -Laktat: nad+ Dehydrogenase, Catalyz Lactate Conversion menjadi piruvat+ bergantung, atau sebaliknya, yang berlaku terima kasih kepada pemindahan ion hidrida (h-) Dari piruvat ke laktat atau dari NADH hingga piruvat teroksida.
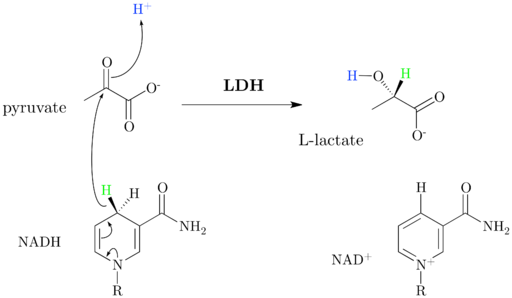 Mekanisme Skim dan Reaksi Dehidrogenase Laktat (Sumber: Jazzlw [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Mekanisme Skim dan Reaksi Dehidrogenase Laktat (Sumber: Jazzlw [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) NAD+ Ia mempunyai unit ADP dan kumpulan nukleotik lain yang diperolehi daripada asid nikotinik, juga dikenali sebagai niacin atau vitamin B3, Dan koenzim ini mengambil bahagian dalam pelbagai reaksi kepentingan biologi yang hebat.
Adalah penting untuk menyerlahkan bahawa keseimbangan dalam tindak balas ini dipindahkan ke sisi yang sepadan dengan laktat dan telah ditunjukkan bahawa enzim juga dapat mengoksidakan asid lain (S) -2 -hydroximonocarboxylic dan penggunaan, walaupun kurang cekap, NADP+ sebagai substrat.
Bergantung pada rantau badan yang dipertimbangkan dan, pada masa yang sama, ciri -ciri metaboliknya berhubung dengan kehadiran atau ketiadaan oksigen, tisu menghasilkan jumlah laktat yang berlainan, produk reaksi yang dikatal oleh LDH oleh LDH.
Jika, sebagai contoh, sel darah merah (erythrocyte) yang tidak mempunyai mitokondria yang boleh memetabolisme piruvat yang dihasilkan semasa glikolisis ke CO2 Dan air, maka dapat dikatakan bahawa ini adalah sel -sel yang menghasilkan laktat utama dalam tubuh manusia, karena semua piruvat ditukar kepada laktat oleh tindakan dehidrogenase laktat.
Sebaliknya, jika sel -sel hati dan sel -sel otot rangka dipertimbangkan, ini bertanggungjawab untuk menghasilkan jumlah minimum laktat, memandangkan fakta bahawa ini dengan cepat dimetabolisme.
Boleh melayani anda: Sabouraud Agar: Apa, Yayasan, Penyediaan, KegunaanNilai normal
Kepekatan dehidrogenase laktat dalam serum darah adalah hasil dari ekspresi beberapa isoenzim di hati, jantung, otot rangka, erythrocytes, dan tumor, antara lain.
Dalam serum darah, julat normal aktiviti laktat dehidrogenase adalah antara 260 dan 850 U/ml (unit per mililiter), dengan nilai purata 470 ± 130 U/ml. Sementara itu, darah hemoralized mempunyai aktiviti LDH yang berbeza antara 16.000 dan 67.000 u/ml, yang bersamaan dengan purata 34.000 ± 12.000 u/ml.
Apa maksudnya mempunyai LDH yang tinggi?
Kuantifikasi kepekatan dehidrogenase laktat dalam serum darah mempunyai nilai penting dalam diagnosis beberapa hati, hati, penyakit darah dan juga kanser.
Angka aktiviti LDH yang tinggi telah dijumpai pada pesakit dengan infark miokard (kedua -dua eksperimen dan klinikal), serta pesakit kanser, khususnya pada wanita dengan kanser endometrium, ovari, payudara dan rahim.
Bergantung pada isoenzim tertentu yang berada dalam "berlebihan" atau dalam kepekatan yang tinggi, kuantifikasi isoenzim laktat dehidrogenase digunakan oleh banyak doktor merawat untuk menentukan kecederaan kepada tisu (serius atau kronik).
Rujukan
- Bergmeyer, h., Bengkok, e., & Hess, b. (1961). Dehidrogenase laktik. Kaedah analisis enzimatik. Seelag Chemie, GmbH.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Organisasi genomik dehidrogenase laktat manusia-gen. Jurnal Biokimia, 231, 537-541.
- Becker, d. (2003). Asidosis laktik. Penjagaan intensif med, 29, 699-702.
- Malah, j., & Kaplan, n. (1973). Dehidrogens Laktat: Struktur dan Fungsi. Dalam Kemajuan dalam enzimologi dan bidang berkaitan biologi molekul (ms. 61-133).
- Fox, s. Yo. (2006). Fisiologi Manusia (Edisi ke -9.). New York, Amerika Syarikat: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bossuyt, p. M. M. (1997). Nilai klinikal dehidrogenase laktat dalam serum: Kajian kuantitatif. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Jawatankuasa Tatanama Kesatuan Antarabangsa Biokimia dan Biologi Molekul (NC-IBMB). (2019). Diperolehi daripada www.Qmul.Ac.UK/SBCS/IUBMB/enzim/indeks.Html
- Rawn, j. D. (1998). Biokimia. Burlington, Massachusetts: Penerbit Neil Patterson.
- Usategui-Gomez, m., Wicks, r. W., & Warshaw, m. (1979). Penentuan Immunochemical of the Heart isoenzyme laktat dehidrogenase (LDH1) dalam serum manusia. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & Ladue, J. S. (1955). Aktiviti degydrogenase laktik dalam darah. Biologi dan Perubatan Eksperimen, 90, 210-215.

