Undang-undang Beer-Lambert
- 1139
- 69
- Donnie Ryan
Apa itu Undang-undang Beer-Lambe?
The Undang-undang Beer-Lambert (Bir-Bouguer) adalah salah satu yang mengaitkan penyerapan sinaran elektromagnetik satu atau lebih spesies kimia, dengan kepekatannya dan jarak yang mengalir cahaya dalam interaksi zarah-foton. Undang -undang ini menyatukan dua undang -undang dalam satu.
Undang -undang Bouguer (walaupun pengiktirafan telah jatuh lebih banyak mengenai Heinrich Lambert), menegaskan bahawa sampel akan menyerap radiasi yang lebih besar apabila dimensi persekitaran penyerap atau material lebih besar; Khususnya, ketebalannya, yang menjadi jarak L yang berjalan melalui cahaya ketika masuk dan keluar.
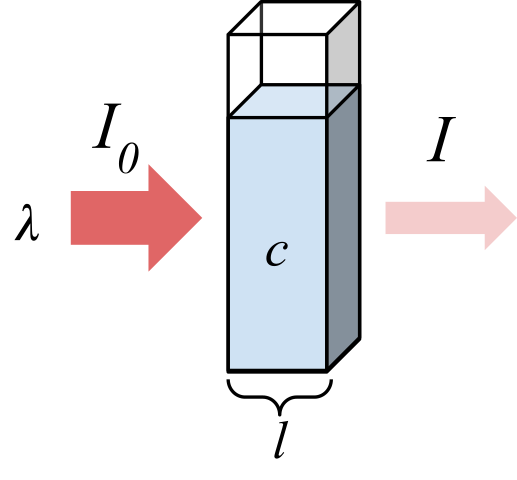 Radiasi yang diserap oleh sampel. Sumber: Marmot2019 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons
Radiasi yang diserap oleh sampel. Sumber: Marmot2019 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons Imej unggul menunjukkan penyerapan radiasi monokromatik; iaitu, terdiri daripada panjang gelombang tunggal, λ. Medium penyerap berada di dalam sel optik, yang ketebalannya L, dan mengandungi spesies kimia dengan kepekatan c.
Rasuk cahaya mempunyai intensiti awal dan akhir, ditetapkan dengan simbol i0 dan saya, masing -masing. Perhatikan bahawa selepas berinteraksi dengan medium penyerap, saya kurang daripada i0, yang menunjukkan bahawa terdapat penyerapan radiasi. Semakin tua mereka c dan L, lebih kecil akan saya berkenaan dengan i0; iaitu, akan ada lebih banyak penyerapan dan kurang transmisi.
Penjelasan Undang-undang Beer-Lambe
Imej unggul dengan sempurna merangkumi undang -undang ini. Penyerapan radiasi dalam sampel meningkat atau berkurangan secara eksponen bergantung pada c Sama ada L. Untuk membiarkan undang -undang sepenuhnya dan mudah difahami, perlu untuk sempadan aspek matematiknya.
Seperti yang baru disebutkan, saya0 Dan saya adalah intensiti rasuk cahaya monokromatik sebelum dan selepas cahaya, masing -masing. Beberapa teks lebih suka menggunakan simbol P0 dan p, yang merujuk kepada tenaga radiasi dan bukan keamatannya. Di sini, penjelasan akan terus menggunakan intensiti.
Boleh melayani anda: acetophenoneUntuk secara linearize persamaan undang -undang ini, logaritma mesti digunakan, biasanya asas 10:
Log (i0/I) = εLc
Istilah (i0/I) Menunjukkan berapa intensiti produk radiasi penyerapan berkurangan. Undang -undang Lambert menganggap l (εl) sahaja, sementara bir mengabaikan l, tetapi tempat c Sebaliknya (εc). Persamaan yang lebih tinggi adalah kesatuan kedua-dua undang-undang, dan oleh itu adalah ungkapan matematik umum untuk undang-undang bir-lambe.
Penyerapan dan transmisi
Penyerapan ditakrifkan oleh log istilah (i0/Yo). Oleh itu, persamaan dinyatakan seperti berikut:
A = εlc
Di mana ε adalah pekali kepupusan atau penyerapan molar, yang tetap pada panjang gelombang tertentu.
Perhatikan bahawa jika ketebalan penyerap tetap tetap, sama seperti ε, penyerapan bergantung semata -mata pada kepekatan c, spesies penyerap. Di samping itu, ia adalah persamaan linear, y = mx, di mana dan adalah, dan x adalah c.
Apabila penyerapan meningkat, transmisi berkurangan; Ini, berapa banyak radiasi yang dapat dihantar selepas penyerapan. Oleh itu, mereka terbalik. Ya0/Saya menunjukkan tahap penyerapan, i/i0 Ia sama dengan transmisi. Mengetahui ini:
Saya/i0 = T
(Yo0/I) = 1/t
Log (i0/I) = log (1/t)
Tetapi, log (i0/I) ia juga sama dengan penyerapan. Jadi hubungan antara dan T ialah:
A = log (1/t)
Dan menggunakan sifat logaritma dan mengetahui bahawa log1 adalah sama dengan 0:
A = -logt
Biasanya penghantaran dinyatakan dalam peratusan:
%T = i/i0∙ 100
Graf
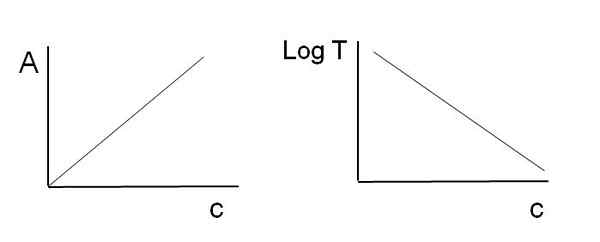
Seperti yang dinyatakan di atas, persamaan sesuai dengan fungsi linear; Oleh itu, diharapkan apabila grafik mereka, mereka akan memberikan garis.
Boleh melayani anda: Apakah kinetik kimia? Grafik yang digunakan untuk undang-undang bir-lambert. Sumber: Gabriel Bolívar
Grafik yang digunakan untuk undang-undang bir-lambert. Sumber: Gabriel Bolívar Perhatikan bahawa di sebelah kiri imej di atas anda mempunyai garis yang diperolehi semasa grafik terhadap c, dan di sebelah kanan garis sepadan dengan graf logt terhadap c. Seseorang mempunyai cerun positif, dan yang lain negatif; Semakin besar penyerapan, semakin rendah transmisi.
Terima kasih kepada linearity ini, kepekatan spesies kimia penyerap (kromofor) dapat ditentukan jika diketahui berapa banyak radiasi yang diserap (a), atau berapa banyak radiasi yang dihantar (LOGT). Apabila linier ini tidak dipatuhi, dikatakan bahawa ia menghadapi sisihan, positif atau negatif, undang-undang bir-lambert.
Permohonan Undang-undang Beer-Lambe
Secara umum, beberapa aplikasi yang paling penting dalam undang -undang ini disebutkan di bawah:
-Sekiranya spesies kimia mempunyai warna, ia adalah calon teladan yang akan dianalisis dengan teknik kolorimetrik. Ini berdasarkan undang-undang bir-Lambert, dan membolehkan untuk menentukan kepekatan analisis berdasarkan penyerapan yang diperoleh dengan spektrofotometer.
-Ia membolehkan untuk membina lengkung penentukuran, yang dengan mengambil kira kesan matriks sampel, kepekatan spesies kepentingan ditentukan.
-Ia digunakan secara meluas untuk menganalisis protein, kerana beberapa asid amino mempunyai penyerapan penting di rantau ultraviolet spektrum elektromagnetik.
-Reaksi kimia atau fenomena molekul yang menyiratkan perubahan pewarna, boleh dianalisis dengan nilai penyerapan, pada satu atau lebih panjang gelombang.
-Membuat analisis multivariate, campuran kromofor kompleks boleh dianalisis. Dengan cara ini, kepekatan semua analisis dapat ditentukan, dan juga, mengklasifikasikan campuran dan membezakannya dari satu sama lain; Sebagai contoh, menolak jika dua mineral yang sama berasal dari benua atau negara tertentu yang sama.
Boleh melayani anda: asid kuatLatihan yang diselesaikan
Latihan 1
Apakah penyerapan penyelesaian yang membentangkan transmisi 30% kepada panjang gelombang 640 nm?
Untuk menyelesaikannya, cuma pergi ke definisi penyerapan dan transmisi.
%T = 30
T = (30/100) = 0.3
Dan mengetahui bahawa a = -logt, pengiraan adalah langsung:
A = -log 0.3 = 0.5228
Perhatikan bahawa anda kekurangan unit.
Latihan 2
Sekiranya pembubaran tahun sebelumnya terdiri daripada spesies w yang kepekatannya ialah 2.30 ∙ 10-4 M, dan mengandaikan bahawa sel mempunyai ketebalan 2 cm: apa yang harus menjadi tumpuannya untuk mendapatkan transmisi 8%?
Ia dapat diselesaikan secara langsung dengan persamaan ini:
-Logt = εlc
Tetapi, nilai ε tidak diketahui. Oleh itu, ia mesti dikira dengan data terdahulu, dan diandaikan bahawa ia tetap tetap dalam pelbagai kepekatan:
ε = -logt/lc
= (-Log 0.3)/ (2 cm x 2.3 ∙ 10-4 M)
= 1136.52 m-1∙ cm-1
Dan sekarang, anda boleh meneruskan untuk mengira dengan %t = 8:
C = -Logt/εl
= (-Log 0.08)/ (1136.52 m-1∙ cm-1 x 2cm)
= 4.82 ∙ 10-4 M
Kemudian, sudah cukup bahawa spesies W menggandakan kepekatannya (4.82/2.3) untuk mengurangkan peratusan transmisi sebanyak 30% hingga 8%.
Rujukan
- Undang-undang Beer-Lambert. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Undang-undang Beer-Lambert. Pulih dari: chemguide.co.UK

