Undang-undang Ritchter-Wenzel Apa, Cerita, Kenyataan, Contoh
- 3068
- 825
- Ms. Santos Fritsch
The Undang-undang Ritchter-Wenzel atau perkadaran timbal balik adalah salah satu yang menegaskan bahawa perkadaran besar antara dua sebatian membolehkan menentukan sebatian ketiga. Ia adalah salah satu undang -undang stoikiometri, bersama -sama dengan undang -undang lavoisier (undang -undang pemuliharaan jisim); undang -undang proust (undang -undang perkadaran yang ditetapkan); dan undang -undang Dalton (undang -undang pelbagai perkadaran).
Ritcher menyatakan undang -undangnya pada tahun 1792 dalam sebuah buku yang menentukan asas -asas stoikiometri, berdasarkan kerja penyelidikan Carl f Wenzel, yang pada tahun 1777 menerbitkan jadual kesetaraan pertama untuk asid dan pangkalan.
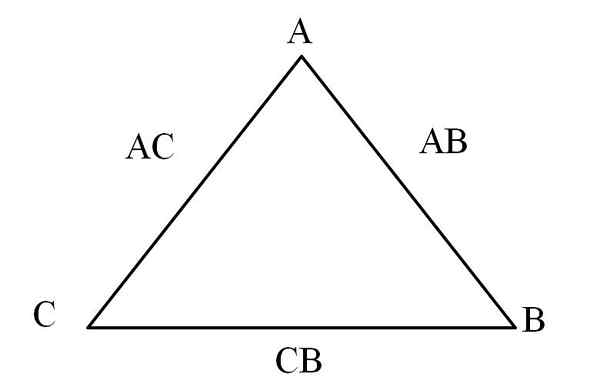
 Segitiga timbal balik. Sumber: Gabriel Bolívar
Segitiga timbal balik. Sumber: Gabriel Bolívar Cara mudah untuk memvisualisasikannya adalah melalui "segitiga timbal balik" (imej unggul). Sekiranya massa A, C dan B diketahui yang bercampur untuk membentuk sebatian AC dan AB, dapat ditentukan berapa banyak C dan B bercampur atau bertindak balas untuk membentuk sebatian CB.
Dalam sebatian AC dan AB elemen A hadir dalam kedua -duanya, jadi apabila membahagikan perkadaran massa mereka adalah berapa banyak C bertindak balas dengan b.
[TOC]
Sejarah dan umum undang -undang perkadaran timbal balik
Richter mendapati bahawa bahagian berat sebatian yang digunakan dalam tindak balas kimia selalu sama.
Dalam hal ini, Ritcher mendapati bahawa 615 bahagian diperlukan oleh berat magnesia (MGO), sebagai contoh, untuk meneutralkan 1000 bahagian mengikut berat asid sulfurik.
Antara 1792 dan 1794, Ritcher menerbitkan ringkasan tiga jilid yang mengandungi karyanya mengenai undang -undang perkadaran yang ditetapkan. Ringkasan itu mencuba stoikiometri, mendefinisikannya sebagai seni pengukuran kimia.
Boleh melayani anda: kromatografi lapisan halus: ciri -ciri, apa ituMenunjuk, di samping itu, stoikiometri berurusan dengan undang -undang mengikut bahan -bahan yang bergabung untuk membentuk sebatian. Walau bagaimanapun, kerja penyelidikan Richter dikritik kerana rawatan matematik yang digunakannya, dengan menyatakan bahawa dia menyesuaikan hasilnya.
Pada tahun 1802, Ernst Gottfried Fischer menerbitkan jadual pertama kesamaan kimia, yang menggunakan asid sulfurik dengan angka 1000; Sama dengan nilai yang dijumpai oleh Richter, untuk peneutralan asid sulfurik oleh magnesia.
Walau bagaimanapun, telah dinyatakan bahawa Richter membina jadual gabungan peso yang menunjukkan perkadaran di mana beberapa sebatian bertindak balas. Sebagai contoh, ia menunjukkan bahawa 859 bahagian NaOH meneutralkan 712 bahagian HNO3.
Pernyataan dan akibatnya
Pernyataan Undang-undang Richter-Wenzel adalah seperti berikut: Massa dari dua unsur yang berbeza yang digabungkan dengan jumlah yang sama dari elemen ketiga, menjaga hubungan yang sama dengan massa unsur-unsur tersebut apabila digabungkan antara satu sama lain.
Undang-undang ini dibenarkan menubuhkan berat badan yang setara, atau gram mencukur berat, seperti jumlah elemen atau sebatian yang akan bertindak balas dengan jumlah tetap bahan rujukan.
Richter dipanggil sebagai gabungan berat yang berkaitan dengan berat unsur -unsur yang digabungkan dengan setiap gram hidrogen. Berat kombinasi relatif Richter sesuai dengan apa yang kini dikenali sebagai berat yang setara dengan unsur -unsur atau sebatian.
Selaras dengan pendekatan sebelumnya, undang-undang Richter-Wenzel boleh dinyatakan seperti berikut:
Berat gabungan unsur -unsur yang berbeza yang digabungkan dengan berat tertentu unsur tertentu adalah berat gabungan relatif unsur.
Ia dapat melayani anda: Kaedah pemisahan campuran heterogenContoh
Kalsium klorida
Dalam kalsium oksida (CaO), 40 g kalsium digabungkan dengan 16 g oksigen (O). Sementara itu, dalam hypochlorous oxide (CL2O), 71 g klorin digabungkan dengan 16 g oksigen. Apa kompaun yang akan dibentuk kalsium jika digabungkan dengan klorin?
Menggunakan segitiga timbal balik, oksigen adalah elemen umum untuk kedua -dua sebatian. Perkadaran massa dua sebatian oksigen ditentukan terlebih dahulu:
40g ca/16 go = 5g ca/2g atau
71g Cl/16g atau
Dan kini membahagikan dua bahagian besar Cao dan CL2Atau kita akan mempunyai:
(5G CA/2G O)/(71G CL/16G O) = 80G CA/142G CL = 40G CA/71G CL
Perhatikan bahawa undang -undang perkadaran massa dipenuhi: 40 g kalsium bertindak balas dengan 71 g klorin.
Sulfur oksida
Oksigen dan sulfur bertindak balas dengan tembaga untuk memberikan tembaga (CUO) dan tembaga sulfida (CUS),. Berapa banyak sulfur akan bertindak balas dengan oksigen?
Dalam oksida tembaga, 63.5 g tembaga digabungkan dengan 16 g oksigen. Dalam sulfida tembaga, 63.5 g tembaga disambungkan pada 32 g sulfur. Membahagikan perkadaran besar -besaran yang kita ada:
(63.5g Cu/16g O)/(63.5g Cu/32g s) = 2032g S/1016g O = 2g S/1g atau
Perkadaran Massa 2: 1 adalah berganda dari 4 (63.5/16), yang menunjukkan bahawa undang -undang Richter dipenuhi. Dengan perkadaran ini, SO, sulfur monoksida (32 g sulfur bertindak balas dengan 16 g oksigen) diperolehi.
Sekiranya perkadaran ini dibahagikan dengan dua, akan ada 1: 1. Sekali lagi, sekarang 4 atau 2, dan oleh itu ia adalah SO2, sulfur dioksida (32g sulfur bertindak balas dengan 32 g oksigen).
Boleh melayani anda: Fucosa: Ciri, Struktur, FungsiSulfida dan oksida besi
Besi sulfida (FES) bertindak balas, di mana 32 g sulfur digabungkan dengan 56 g besi, dengan oksida ferus (hodoh), di mana 16 g oksigen digabungkan dengan 56 g besi. Unsur ini berfungsi sebagai rujukan.
Dalam FES dan sebatian reaksi hodoh, sulfur dan oksigen (O) berhubung dengan besi (iman) didapati dalam perkadaran 2: 1. Dalam sulfur oksida (SO) 32 g sulfur digabungkan dengan 16 g oksigen, jadi sulfur dan oksigen didapati dalam perkadaran 2: 1.
Ini menunjukkan bahawa undang -undang perkadaran timbal balik atau undang -undang Richter dipenuhi.
Perkadaran yang terdapat di antara sulfur dan oksigen dalam sulfur oksida (2: 1), boleh digunakan, sebagai contoh, untuk mengira berapa banyak oksigen bertindak balas dengan 15 g sulfur.
o oksigen g = (15g s) ∙ (1g o/2g s) = 7.5g
Rujukan
- Undang -Undang Peratusan Relocal: Definisi & Contohnya. Kajian. Pulih dari: belajar.com
- Undang -undang perkadaran timbal balik. Kimia Librettexts. Pulih dari: chem.Libretxts.org

