Model bahan korpuskular
- 779
- 114
- Donnie Ryan
 Negeri -negeri yang paling terkenal mengenai perkara ini mempunyai penjelasan mereka dalam model korpuskular perkara itu
Negeri -negeri yang paling terkenal mengenai perkara ini mempunyai penjelasan mereka dalam model korpuskular perkara itu Apakah model bahan korpuskular?
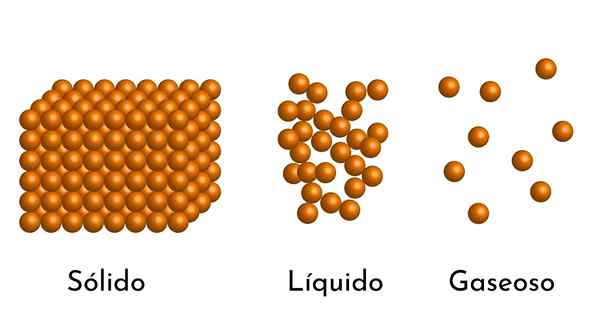
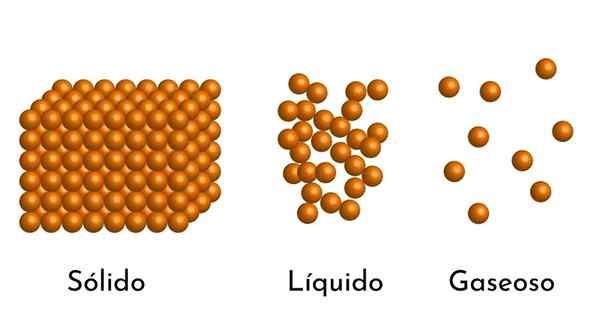
Dia Model bahan korpuskular Ini adalah model struktur mikroskopik perkara, yang bertujuan untuk menerangkan sifat dan tingkah laku dalam setiap keadaan pengagregatan.
Postulat asas model adalah perkara itu terdiri daripada zarah kecil, yang boleh menjadi atom, ion atau molekul, selalu dalam pergolakan berterusan.
Dalam model ini, undang -undang mekanik klasik untuk zarah dikenakan, walaupun dengan jumlah yang besar, mereka tidak dikaji secara individu tetapi melalui rawatan statistik. Dengan cara ini, nilai purata magnitud makroskopik minat, seperti tekanan, suhu dan kelantangan diperolehi.
Model korpuskular juga menerangkan sifat seperti kelikatan, kekerasan, fleksibiliti dan ketumpatan bahan, serta peleburan terma, antara fenomena lain.
Asal -usul Model Korpuskular
Idea mengenai sifat corpuskular tarikh perkara sekurang -kurangnya abad ke -5.C. Di Yunani kuno, Leucipo (450 a. C. - 370 a. C.) dan demokritus (460 hingga 370 hingga c), muridnya, telah membuat spekulasi mengenai organisasi perkara di peringkat mikroskopik.
Ahli falsafah ini mencadangkan perkara itu terdiri daripada zarah -zarah yang tidak dapat dipisahkan, yang dilantik atom, Kata akar Yunani yang bermaksud "tidak dapat dipisahkan".
Teori ini diketepikan oleh Aristotle, yang paling berpengaruh pada waktunya. Walau bagaimanapun, tidak sampai abad ketujuh belas bahawa teori korpuskular mula mengambil kaitan lagi, dan pada abad ke -19, rahsia perkara akhirnya mula mendedahkan.
Pada tahun 1803 ahli kimia Inggeris John Dalton (1766-1844) sekali lagi mencadangkan bahawa perkara itu dibentuk oleh corpuscles yang dipanggil atom, yang digabungkan dalam perkadaran tertentu untuk membentuk molekul bahan.
Atom Dalton tidak dapat dipisahkan, tetapi tidak lama lagi struktur teoretikal pepejal telah dibangunkan, terutama terima kasih kepada James C. Maxwell (1831-1979) dan Ludwig Boltzmann (1844-1906). Ini menubuhkan asas mekanik statistik dan fizik keadaan pepejal.
Ia dapat melayani anda: kelajuan purata: formula, bagaimana ia dikira dan diselesaikanAsas Model Korpuskular
Postulat utama model adalah:
- Perkara, tanpa mengira status pengagregatan mereka, dibentuk oleh zarah mikroskopik, yang boleh menjadi atom individu atau gabungan, untuk membentuk molekul.
- Bahan yang berbeza berbeza antara satu sama lain kerana ia dibentuk oleh zarah yang berbeza.
- Menurut keadaan pengagregatan bahan, terdapat ruang kosong di antara zarah, lebih besar dalam gas dan lebih kecil dalam pepejal.
- Zarah -zarah yang membentuk perkara itu dalam pergolakan kekal. Kepada pergolakan yang lebih besar, tenaga kinetik yang lebih besar yang mereka ada, dan jika haba ditambah, pergerakan zarah meningkat.
- Juga, dalam cecair dan pepejal, zarah mengalami tarikan keamatan yang berbeza, disebabkan oleh daya intermolecular. Dalam gas, molekul sangat berasingan dan bergerak dengan cepat, jadi kuasa -kuasa ini tidak mempunyai kejadian yang lebih besar. Tetapi dalam cecair, yang zarahnya mempunyai lebih banyak perpaduan, daya ini lebih sengit, dan dalam pepejal ia lebih besar.
Teori Kinetik Gas
Model corpuskular digunakan terlebih dahulu untuk gas, kerana ia adalah keadaan agregasi dan daya perpaduan yang paling mudah di antara molekul adalah minimum. Di samping itu, sifat -sifat gas terkenal melalui karya -karya eksperimen ahli kimia Inggeris Robert Boyle dan Joseph Gay Lussac dan Jacques Charles Perancis dan Jacques.
Model Gas Ideal, yang paling mudah, merenungkannya:
- Saiz zarah jauh lebih kecil daripada jarak di antara mereka, dan dimensi bekas. Mereka adalah massa tertentu, iaitu, kekurangan dimensi dan tidak menduduki jumlah.
- Zarah -zarah itu berada dalam pergolakan kekal, sebagai pergerakan mereka hanya terjemahan.
- Kadang -kadang zarah bertembung secara elastik, antara satu sama lain dan dengan dinding bekas. Dalam kejutan elastik tenaga kinetik yang benar -benar dipelihara.
- Tidak ada daya menarik antara molekul. Satu -satunya interaksi adalah disebabkan oleh perlanggaran yang berlaku dari semasa ke semasa dan untuk masa yang sangat singkat. Selebihnya, setiap molekul bertindak tanpa mengira yang lain.
- Sekiranya tidak ada daya luaran yang bertindak ke atas sistem zarah, ini diedarkan secara seragam sepanjang jumlah yang ada.
Walaupun ini adalah model yang paling mudah, menerangkan tingkah laku gas padat pada suhu tinggi dan tekanan rendah. Para saintis telah membangunkan model lain yang diselaraskan yang lebih baik untuk tingkah laku gas sebenar, kerana ini mereka menganggapnya:
- Molekul mempunyai saiz yang boleh diukur.
- Daya intermolecular tidak dibatalkan.
Persamaan Gas Ideal
Terima kasih kepada postulates gas yang ideal, ungkapan timbul yang berkaitan dengan magnitud makroskopik tekanan p, volum V dan suhu T:
P ∙ v = nrt
Di mana n adalah bilangan tahi lalat gas dan r adalah pemalar universal gas, yang nilainya dalam unit sistem antarabangsa adalah 8.314 j/mol ∙ k.
Tenaga dan suhu kinetik
Dalam gas yang ideal, semua tenaga dalaman menunjukkan dirinya sebagai tenaga kinetik. Tenaga kinetik purata n molekul N gas ideal adalah berkadar terus dengan suhunya di Kelvin:
Model corpuskular dalam cecair dan pepejal
Sebenarnya, semua perkara boleh didapati di tiga negeri yang paling mudah: seperti gas, cecair atau pepejal, bergantung pada tekanan dan suhu. Terdapat negara pengagregatan lain seperti plasma, tetapi tidak dekat dengan permukaan bumi.
Negeri -negeri ini disebabkan oleh cara daya tarikan intermolecular bertindak, yang pendek, iaitu, mereka tidak bertindak jika jarak antara molekul sangat besar dan zarah bergerak pada kelajuan tinggi. Ini adalah kes gas, yang membolehkan fenomena penyebaran lebih cepat. Ini menjelaskan bahawa dengan mengungkap aroma, aroma merebak dengan cepat.
Boleh melayani anda: Apakah momen magnet?Sebaliknya, apabila zarah lebih dekat dan pergerakannya lebih perlahan, seperti dalam cecair dan pepejal, daya intermolecular ini mempunyai peluang untuk melakukan tindakan mereka.
Oleh itu, apabila gas berlalu ke keadaan cair, jumlahnya berkurangan, kerana jarak antara zarahnya berkurangan, dan lebih banyak lagi apabila ia menjadi pepejal.
Perkara dalam keadaan cair
Dalam keadaan cair, daya intermolecular tidak hina, tetapi bertindak pada skala yang lebih kecil daripada keadaan pepejal. Zarah membentuk kumpulan kecil, yang hancur dan berkumpul semula secara berterusan, memberikan mobiliti kepada bahan, walaupun mengekalkan kelantangan tetap.
Mobiliti ini membolehkan cecair menyesuaikan diri dengan bentuk bekas dan memberi mereka keupayaan untuk mengalir, selain dapat bercampur dengan lebih mudah. Penyebaran boleh berlaku, tetapi lebih perlahan daripada gas.
Walaupun begitu, zarah mempunyai kohesi yang mencukupi sehingga cecair tetap tidak dapat dikompresikan dalam julat suhu yang luas.
Ketegangan permukaan
Di permukaan bendalir terdapat molekul di mana daya intermolecular tidak seimbang, menimbulkan daya bersih. Daya bersih ini diminimumkan apabila cecair mempunyai permukaan yang paling rendah.
Terima kasih kepada daya ini, pin, klip, serangga dan objek kecil lain yang dapat kekal di permukaan air tanpa tenggelam.
 Dalam imej ini molekul dapat dilihat di permukaan cecair, di mana daya bersih bertindak, yang membolehkan serangga berjalan di atas air tanpa tenggelam
Dalam imej ini molekul dapat dilihat di permukaan cecair, di mana daya bersih bertindak, yang membolehkan serangga berjalan di atas air tanpa tenggelam Perkara keadaan pepejal
Dalam keadaan pepejal zarah -zarah sangat dekat antara satu sama lain, dan daya intermolecular menjadikan zarah tetap berada di kedudukan tetap. Walaupun mereka dapat bergetar di sekitar kedudukan ini, pepejal mengamalkan bentuk yang ditetapkan dan mengekalkan jumlah tetap mereka.
Apabila haba mengalir, amplitud pergerakan getaran meningkat dan suhu meningkat. Ini menyebabkan dimensi badan meningkat dengan suhu, fenomena yang dipanggil Peleburan haba. Sekiranya aliran haba yang cukup, pepejal juga boleh pergi ke fasa cecair.


