Notasi spektrum

- 5090
- 1276
- Delbert Dare
 Jadual yang menunjukkan tahap dan orbital
Jadual yang menunjukkan tahap dan orbital Apakah notasi spektrum?
The Notasi spektrum Ia adalah susunan elektron pada tahap tenaga di sekitar nukleus atom. Menurut model atom lama Bohr, elektron menduduki beberapa tahap di orbit di sekitar nukleus, lapisan pertama yang paling dekat dengan nukleus, k, ke lapisan ketujuh, q, yang paling jauh dari nukleus.
Dari segi model mekanikal kuantum yang lebih halus, lapisan K-Q dibahagikan kepada satu set orbital, masing-masing boleh diduduki oleh tidak lebih dari beberapa elektron.
Biasanya, konfigurasi elektronik digunakan untuk menggambarkan orbital atom dalam keadaan asasnya, tetapi ia juga boleh digunakan untuk mewakili atom yang telah diionisasi dalam kation atau anion, mengimbangi kehilangan atau keuntungan elektron di orbital masing -masing.
Banyak sifat fizikal dan kimia unsur -unsur boleh dikaitkan dengan konfigurasi elektronik mereka yang unik. Elektron valencia, elektron di lapisan paling luar, adalah faktor penentu bagi kimia unik elemen.
Apabila elektron lapisan paling luar atom menerima tenaga dari beberapa jenis, mereka bergerak ke lapisan tenaga yang lebih besar. Oleh itu, elektron di lapisan K akan dipindahkan ke lapisan L dalam keadaan tenaga terbesar.
Apabila elektron kembali ke keadaan asasnya, ia melepaskan tenaga yang diserap dengan memancarkan spektrum elektromagnet (cahaya). Oleh kerana setiap atom mempunyai konfigurasi elektronik tertentu, ia juga akan mempunyai spektrum tertentu yang akan dipanggil spektrum penyerapan (atau pelepasan).
Atas sebab ini, notasi spektrum istilah digunakan untuk merujuk kepada konfigurasi elektronik.
Cara Menentukan Notasi Spektrum: Nombor Kuantum
Sebanyak empat nombor kuantum digunakan untuk menggambarkan sepenuhnya pergerakan dan trajektori setiap elektron di dalam atom.
Gabungan semua nombor kuantum semua elektron dalam atom digambarkan oleh fungsi gelombang yang memenuhi persamaan Schrödinger. Setiap elektron dalam atom mempunyai set nombor kuantum yang unik.
Ia boleh melayani anda: pecahan molar: bagaimana ia dikira, contoh, latihanMenurut prinsip pengecualian Pauli, dua elektron tidak dapat berkongsi kombinasi yang sama dengan empat nombor kuantum.
Nombor kuantum adalah penting kerana ia boleh digunakan untuk menentukan konfigurasi elektronik atom dan lokasi kemungkinan elektron atom.
Nombor kuantum juga digunakan untuk menentukan ciri -ciri lain atom, seperti tenaga pengionan dan jejari atom.
Nombor kuantum menetapkan cengkerang, subkap, orbital dan elektron tertentu.
Ini bermakna mereka benar -benar menggambarkan ciri -ciri elektron dalam atom, iaitu, mereka menggambarkan setiap penyelesaian tunggal untuk persamaan Schrödinger, atau fungsi gelombang, elektron dalam atom.
Terdapat sejumlah empat nombor kuantum: nombor kuantum utama (n), bilangan kuantum sudut orbital (L), nombor kuantum magnet (ml) dan nombor kuantum spin elektron (MS).
Nombor kuantum utama, NN, menggambarkan tenaga elektron dan jarak yang paling mungkin dari elektron teras. Dengan kata lain, ia merujuk kepada saiz orbital dan tahap tenaga di mana elektron diletakkan.
Bilangan subcaps, atau ll, menggambarkan bentuk orbital. Ia juga boleh digunakan untuk menentukan bilangan nod sudut.
Nombor kuantum magnet, ml, menerangkan tahap tenaga dalam subcap, dan lebih banyak merujuk kepada putaran pada elektron, yang boleh naik atau turun.
Prinsip Aufbau
Aufbau berasal dari perkataan Jerman Aufbauen, Apa maksud "membina". Pada dasarnya, ketika menulis konfigurasi elektron kita sedang membina orbital elektron ketika kita maju dari satu atom ke yang lain.
Semasa kita menulis konfigurasi elektronik atom, kita akan mengisi orbital dalam meningkatkan urutan nombor atom.
Prinsip Aufbau berasal dari prinsip pengecualian Pauli, yang mengatakan tidak ada dua fermion (contohnya, elektron) dalam atom.
Ia boleh melayani anda: asid butyric: formula, sifat, risiko dan kegunaanMereka boleh mempunyai set nombor kuantum yang sama, jadi mereka perlu "mengumpul" pada tahap tenaga yang lebih tinggi. Bagaimana elektron terkumpul adalah topik tetapan elektron.
Atom yang stabil mempunyai banyak elektron seperti yang dilakukan oleh proton dalam nukleus. Elektron berkumpul di sekitar nukleus dalam orbital kuantum mengikut empat peraturan asas yang disebut prinsip aufbau.
1. Tidak ada dua elektron dalam atom yang berkongsi empat nombor kuantum yang sama N, L, M, dan S.
2. Elektron akan terlebih dahulu menduduki orbital tahap tenaga terendah.
3. Elektron akan mengisi orbital selalu dengan nombor putaran yang sama. Apabila orbital penuh, ia akan bermula.
4. Elektron akan mengisi orbital untuk jumlah nombor kuantum n dan l. Orbital dengan nilai yang sama (n + l) akan diisi terlebih dahulu dengan nilai n yang lebih rendah.
Peraturan kedua dan keempat pada dasarnya sama. Contoh Peraturan Empat adalah orbital 2p dan 3s.
2p orbital adalah n = 2 dan l = 2 dan orbital 3s ialah n = 3 dan l = 1. (N + l) = 4 dalam kedua -dua kes, tetapi orbital 2p mempunyai tenaga terendah atau nilai yang lebih rendah dan akan diisi sebelum lapisan 3s.
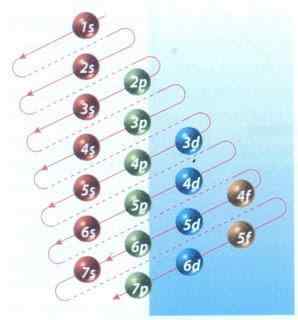 Rajah 2: Rajah Moeller pengisian konfigurasi elektronik
Rajah 2: Rajah Moeller pengisian konfigurasi elektronik Nasib baik, anda boleh menggunakan rajah Moeller yang ditunjukkan dalam Rajah 2 untuk mengisi elektron. Grafik dibaca dengan melaksanakan pepenjuru dari 1s.
Rajah 2 menunjukkan orbital dan anak panah atom menunjukkan cara untuk mengikuti.
Sekarang diketahui bahawa urutan orbital diisi, satu -satunya perkara yang tersisa adalah menghafal saiz setiap orbital.
Orbital mempunyai 1 kemungkinan nilai mL Mengandungi 2 elektron
Orbital p mempunyai 3 nilai yang mungkin mL Mengandungi 6 elektron
Orbital mempunyai 5 kemungkinan nilai mL Mengandungi 10 elektron
Orbital f mempunyai 7 nilai yang mungkinL Mengandungi 14 elektron
Ini semua yang diperlukan untuk menentukan konfigurasi elektronik atom stabil elemen.
Boleh melayani anda: Dodecil natrium sulfat (SDS): Struktur, sifat, kegunaanContohnya, ambil elemen nitrogen. Nitrogen mempunyai tujuh proton dan, oleh itu, tujuh elektron. Orbital pertama yang akan diisi adalah 1s orbital. Orbital s mempunyai dua elektron, jadi terdapat lima elektron yang tersisa.
Orbital seterusnya adalah orbital 2s dan mengandungi dua seterusnya. Tiga elektron terakhir akan pergi ke orbital 2p yang boleh mengandungi sehingga enam elektron.
Peraturan tenggelam
Bahagian Aufbau membincangkan bagaimana elektron mengisi orbital tenaga terendah terlebih dahulu dan kemudian bergerak ke orbital tenaga tertinggi hanya selepas orbital tenaga yang lebih rendah penuh.
Walau bagaimanapun, ada masalah dengan peraturan ini. Sudah tentu, orbital 1s mesti diisi sebelum orbital 2s, kerana orbital 1s mempunyai nilai n yang lebih rendah, dan, oleh itu, tenaga yang lebih rendah.
Dan tiga orbital yang berbeza? Di mana perintah harus diisi? Jawapan untuk soalan ini melibatkan peraturan sinki.
Peraturan sink menetapkan bahawa:
- Setiap orbital dalam sub -level diduduki secara individu sebelum mana -mana orbital diduduki dua kali ganda.
- Semua elektron di orbital yang diduduki secara individu mempunyai giliran yang sama (untuk memaksimumkan jumlah keseluruhan).
Apabila elektron ditugaskan ke orbital, elektron mula -mula berusaha mengisi semua orbital dengan tenaga yang sama (juga dipanggil orbital degenerate) sebelum dipadankan dengan elektron lain dalam orbital separuh penuh.
Atom di bumi cenderung mempunyai sebanyak mungkin elektron yang tidak dapat dilihat. Semasa menggambarkan proses ini, pertimbangkan bagaimana elektron mempamerkan tingkah laku yang sama dengan tiang yang sama dalam magnet jika mereka akan menghubungi.
Apabila elektron yang dikenakan secara negatif mengisi orbital, mereka mula -mula cuba melepaskan sebanyak mungkin sebelum terpaksa berpadanan.
Rujukan
- Nombor kuantum. Chem pulih.Libretxts.org.
- Konfigurasi elektron dan sifat atom.F.). Pulih dari Oneonta.Edu.
- Konfigurasi Elektronik. Pulih dari Britannica.com.

