Sifat peroksida, tatanama, kegunaan, contoh
- 809
- 223
- Donnie Ryan
The peroksida Mereka semua adalah sebatian kimia yang mengandungi kumpulan peroxo, O-O, sama ada kovalen dikaitkan dengan atom karbon atau kumpulan fungsi lain, atau dalam bentuk ionik seperti anion peroksida, atau22-. Di atas diwakili secara grafik dalam imej di bawah. Di dalamnya kumpulan O-O menonjol dengan warna biru.
Mungkin ada peroksida organik seperti diaquilperoxides (r1-O-O-R2), Hidroperoksida (r-o-o-h), peracid (rco-o-o-h) dan peéstres (r (r1Co-O-O-R2). Kami juga mempunyai peroksida bukan organik, seperti peroksida logam (mn+Sama ada22-) dan hidrogen peroksida (H-O-H). Yang terakhir adalah yang paling terkenal dari semua, menerima nama hidrogen peroksida.
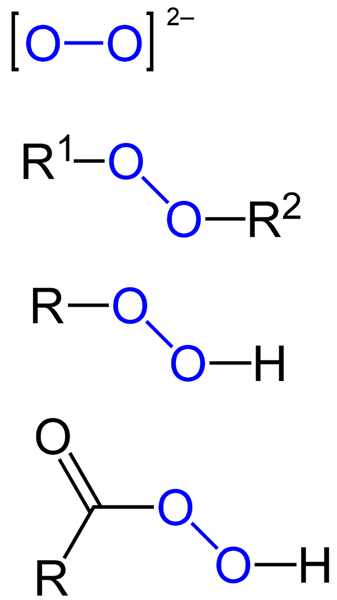 Formula untuk pelbagai jenis peroksida yang wujud. Sumber: Jü / Domain Awam
Formula untuk pelbagai jenis peroksida yang wujud. Sumber: Jü / Domain Awam Semua peroksida berkongsi sama dengan harta yang sangat reaktif, bahan pengoksidaan dan, dalam beberapa kes, letupan. Kecuali mereka tidak ditentukan dengan mensintesisnya, mereka dianggap kekotoran yang tidak diingini dan berbahaya bagi banyak proses perindustrian dan untuk sintesis makmal.
Peroksida secara umum adalah agen pengoksidaan yang sangat baik, pemutihan, bakterisida, dan pengaktifan polimerisasi melalui pembentukan radikal bebas. Itulah sebabnya mereka biasanya reagen atau bahan tambahan yang sangat berguna dalam industri polimer, serta dalam industri makanan untuk mempercepat pengoksidaan dan menghapuskan bakteria.
[TOC]
Sifat peroksida
Struktur
Struktur peroksida memberi tumpuan kepada kumpulan O-O. Setiap atom oksigen mempunyai hibridisasi SP3, Jadi pautan -o -lakukan tidak berehat dalam satah yang sama. Sebagai contoh, untuk hidrogen peroksida, H-O-H, sudut yang terbentuk antara kedua-dua h ialah 115.Ke -5, yang menunjukkan bahawa empat atom tidak berada di atas kapal terbang.
Penyimpangan sudut ini dan lain-lain bergantung kepada identiti serpihan molekul lain yang dikaitkan dengan kumpulan O-O.
Ia boleh melayani anda: Gibbs Free Energy: Units, Bagaimana Ia Dikira, Latihan DiselesaikanSebaliknya, peroksida organik dan organik (kecuali logam) boleh diiktiraf dengan mata kasar jika kumpulan O-O terperinci dalam struktur mereka, seperti dua gelas dengan "mulut". Dengan cara ini, mana -mana peroksida segera dikenal pasti dengan satu pandangan strukturnya.
Reaktiviti
Pautan O-O agak lemah berbanding dengan pautan lain seperti C-H atau C-O. Itulah sebabnya ia cenderung untuk memecahkan atau serpihan untuk menghasilkan radikal oksigen yang sangat reaktif.
Mereka adalah kerana radikal ini bahawa peroksida diklasifikasikan sebagai bahan reaktif dan berbahaya, kerana mereka boleh merosakkan tisu dan bahan organik secara umum.
Tindakan pengoksidaan
Peroksida adalah ejen pengoksidaan yang kuat, berusaha mendapatkan elektron dari alam sekitar untuk berubah menjadi air, oksigen atau hidroksida. Sebagai contoh, hidrogen peroksida adalah ejen oksidan yang lebih kuat daripada kalium permanganat yang sama.
Tindakan pengoksidaan ini digunakan untuk mengesan mereka melalui reaksi mereka dengan sulfat ferus dan kalium tiocyanate:
Peroksida +iman2+ + Scn- → Fe (SCN)n(3-N)- (N = 1 hingga 6).
Kompleks yang terbentuk antara iman3+ dan SCN- Ia adalah merah darah, jadi pemerhatian warna ini sepadan dengan ujian positif untuk kehadiran peroksida dalam sampel.
Kepekaan
Peroksida adalah bahan yang sensitif terhadap suhu tinggi dan cahaya matahari. Oleh itu, mereka mesti disimpan di tapak yang selamat dan dalam bekas plastik dan legap, sehingga cahaya tidak mempengaruhi mereka secara langsung.
Nomenclature
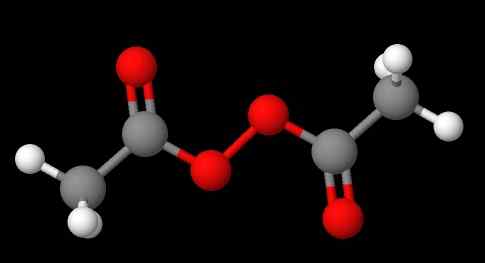
Nomenklatur peroksida bergantung pada jenisnya. Secara umum, ramai yang dilantik dengan menyebut 'peroksida' diikuti oleh substituen r dalam susunan abjad. Contohnya, kompaun CH3C (O) OOC (O) CH3 (imej yang lebih rendah) dipanggil diacetyl atau asetil peroksida, kerana ia mempunyai kumpulan asetil pada setiap hujung.
Boleh melayani anda: natrium sulfat (na2SO4): struktur, sifat, kegunaan, memperoleh Diacetyl peroksida. Sumber: Gabriel Bolívar melalui Molview.
Diacetyl peroksida. Sumber: Gabriel Bolívar melalui Molview. Kompaun c6H5C (o) ooc (o) c6H5 (Imej yang lebih rendah), sebaliknya, ia dipanggil dibenzoílo atau benzoílo peroksida, atas alasan yang sama yang dinyatakan dalam perenggan sebelumnya.
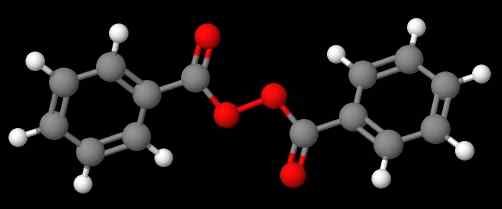 Benzoyl peroksida. Sumber: Gabriel Bolívar melalui Molview.
Benzoyl peroksida. Sumber: Gabriel Bolívar melalui Molview. Sementara itu, kompaun c6H5C (O) OOC (O) CH3 dipanggil asetil benzolelo peroksida. Kali ini substituen asetil disebutkan dahulu untuk memulakan dengan huruf 'a'. Contoh lain ialah CH3Ch2OOC6H5, dipanggil etil fenil peroksida.
Begitu juga dengan hidroperoksida. Contohnya, CHO3OOH dipanggil metil hidroperoksida.
Latihan
Sesetengah peroksida boleh dibentuk secara langsung oleh pendedahan bahan yang dipersoalkan dengan oksigen udara, dibantu atau tidak dengan pemangkin logam. Mereka juga boleh membentuk dengan mendedahkan bahan kepada ozon dalam keadaan tertentu, menjalankan tindak balas ozonolisis.
Laluan sintetik lain adalah untuk bertindak balas hidrogen peroksida dengan alkylorsulfate:
R2SW4 + H2Sama ada2 → R-O-R +H2SW4
Untuk mensintesis atau membentuk peroksida diakili atau bahkan peroksida kitaran.
Sementara itu, beberapa kaedah untuk membentuk peroksida logam didasarkan pada oksigenasi oksida logam masing -masing, sehingga mereka "oksigen" dan pergi dari menjadi mo (mn+Sama ada2-) cinta2 (Mn+Sama ada22-).
Peroksida menggunakan
Pemolimeran pemolimeran
Peroksida, terutamanya peroksida organik, ditambah kepada tindak balas cara untuk sintesis infiniti plastik dan bahan seperti polistirena, silikon, epoksi dan resin akrilik, polyvinyl chloride, gentian kaca, antara yang lain.
Ini kerana mereka mengalami penguraian haba untuk menjadi radikal bebas oksigen, yang seterusnya mencetuskan dan memangkin pempolimeran. Oleh itu, mereka wajar dalam industri polimer.
Ia boleh melayani anda: pecahan molar: bagaimana ia dikira, contoh, latihanBeberapa peroksida yang digunakan sebagai pemula adalah metil cetona (MEK) peroksida, dan aseton peroksida.
Peluntur dan pembasmian kuman
Peroksida adalah agen pemutihan, digunakan untuk kertas pemutihan dan pulpa tepung. Mereka juga ejen pembasmi kuman, benar -benar berkesan tetapi agresif dari segi pembasmian bakteria. Contoh klasik sepadan dengan hidrogen peroksida, yang dimaksudkan dalam penyelesaian yang dicairkan (3%) untuk membasmi kuman.
Ejen pengoksidaan
Peroksida juga mengoksidakan ejen, jadi mereka mendapati banyak kegunaan dalam sintesis organik bahan yang sangat oksigen.
Sumber oksigen
Walaupun ia bukan antara kegunaan utamanya, peroksida juga boleh berfungsi sebagai sumber oksigen dalam beberapa kerosakan mereka. Ini berlaku, sekali lagi, hidrogen peroksida.
Contoh peroksida
Akhirnya, beberapa contoh peroksida akan disenaraikan, sama ada organik atau bukan organik, dengan formula dan nama masing -masing:
-H2Sama ada2: Hidrogen atau hidrogen peroksida
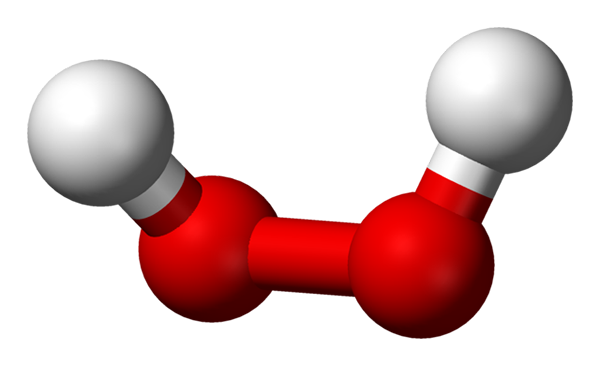 Molekul hidrogen peroksida yang diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 melalui Wikipedia.
Molekul hidrogen peroksida yang diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 melalui Wikipedia. -Na2Sama ada2: Natrium peroksida
-Rasuk2: Barium peroksida
-C6H5C (ch3)2OOH: Cummeno Hydroperoxide
-(NH4)2S2Sama ada8: Ammonium persulfate
- Ho3Sooso3H: Asid peroksidisulfurik
-(Ch3)3COOC (Ch3)3: Ditert-butil peroksida
Rujukan
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Peroksida organik. Diperoleh dari: dalam.Wikipedia.org
- Elsevier b.V. (2020). Peroksida. Scientedirect. Diperoleh dari: Scientedirect.com
- Pembangunan Kimia Lanjutan. (s.F.). Alkohol, fenol, dan mereka mendapat:
- Peroksida Peraturan C-218. Pulih dari: acdlabs.com
- Vol'nov i.Yo., Petrocelli a.W. (1966) Klasifikasi dan tatanama sebatian peroksida bukan organik. Dalam: Petrocelli a.W. (Eds) peroksida, superoksida, dan ozonida logam alkali dan alkali. Springer, Boston, MA.
- « Baja California yang tipikal untuk lelaki dan wanita (keterangan)
- Sifat jualan haloid, tatanama, bagaimana mereka terbentuk, contohnya »

