Polariti (kimia) apakah, definisi, contoh
- 1280
- 111
- Kerry Schmitt
Apakah polaritas kimia?
The Polaritas kimia Ia adalah harta yang dicirikan oleh kehadiran pengagihan heterogen yang ditandakan kepadatan elektronik dalam molekul. Oleh itu, dalam strukturnya, terdapat kawasan yang dimuatkan secara negatif (δ-), dan yang lainnya dikenakan secara positif (δ+), menghasilkan momen dipole.
Momen dipole (μ) pautan adalah bentuk ungkapan polaritas molekul. Ia biasanya diwakili sebagai vektor yang asalnya dalam beban (+) dan akhirnya terletak di dalam beban (-), walaupun beberapa bahan kimia mewakilinya secara terbalik.
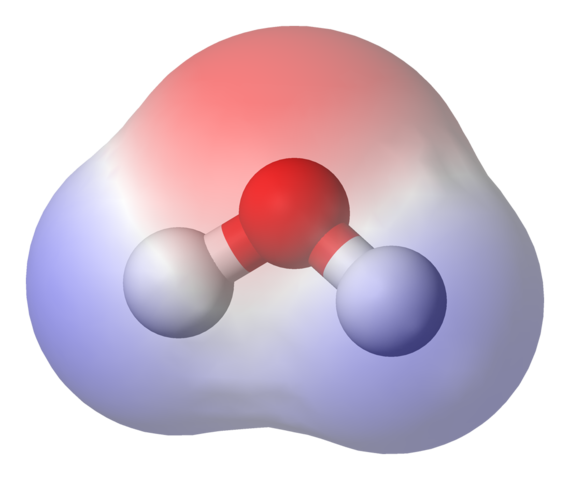
 Peta potensi elektrostatik untuk molekul air. Sumber: Benjah-bmm27 melalui Wikipedia.
Peta potensi elektrostatik untuk molekul air. Sumber: Benjah-bmm27 melalui Wikipedia. Di bahagian atas imej peta potensi elektrostatik untuk air ditunjukkan, h2Sama ada. Rantau kemerahan (atom oksigen) sepadan dengan yang mempunyai ketumpatan elektronik tertinggi, dan ia juga dapat dilihat bahawa ia menonjol di kawasan biru (atom hidrogen).
Oleh kerana pengedaran kepadatan elektronik tersebut heterogen, dikatakan bahawa terdapat kutub positif dan negatif. Itulah sebabnya kita bercakap mengenai polaritas kimia, dan buat masa ini dipole.
Momen dipolar
Momen dipole μ ditakrifkan oleh persamaan berikut:
μ = δ ·d
Di mana δ adalah caj elektrik setiap tiang, positif (+δ) atau negatif (-δ), dan d Ia adalah jarak di antara mereka.
Momen dipol biasanya dinyatakan di Debye, diwakili oleh simbol d. Metro Coulomb · bersamaan dengan 2,998 · 1029 D.
Nilai momen dipole hubungan antara dua atom yang berbeza adalah berkaitan dengan perbezaan elektronegativiti atom yang membentuk pautan.
Untuk molekul menjadi kutub, tidak cukup untuk mempunyai pautan kutub dalam strukturnya, tetapi juga mesti mempunyai geometri asimetri; Dengan cara sedemikian, yang menghalang detik -detik dipole daripada menghilangkan satu sama lain.
Boleh melayani anda: karbonoid: unsur, ciri dan kegunaanAsimetri dalam molekul air
Molekul air mempunyai dua ikatan O-H. Geometri molekul adalah sudut, iaitu, dengan bentuk "V"; Jadi momen dipole pautan tidak membatalkan satu sama lain, tetapi jumlahnya berlaku dengan menunjuk ke arah atom oksigen.
Peta potensi elektrostatik untuk h2Atau mencerminkan ini.
Sekiranya molekul sudut H-O-H diperhatikan, soalan berikut boleh timbul: adakah ia benar-benar tidak simetris? Jika paksi khayalan ditarik yang melintasi atom oksigen, molekul akan dibahagikan kepada dua bahagian yang sama: H-O | O-H.
Tetapi, tidak begitu jika paksi khayalan mendatar. Apabila paksi ini sekarang membahagikan molekul lagi menjadi dua bahagian, atom oksigen akan ada di satu tangan, dan di sisi lain dua atom hidrogen.
Inilah sebabnya simetri jelas H2Atau berhenti wujud, dan oleh itu molekul asimetrik dianggap.
Molekul kutub
Molekul kutub mesti memenuhi siri ciri, seperti:
-Pengagihan caj elektrik dalam struktur molekul adalah asimetrik.
-Mereka biasanya larut dalam air. Ini disebabkan oleh molekul kutub boleh berinteraksi dengan daya dipole-dipolo, di mana air dicirikan dengan mempunyai momen dipole yang besar.
Di samping itu, pemalar dielektriknya sangat tinggi (78.5), yang membolehkan anda mengekalkan beban elektrik yang berasingan meningkatkan kelarutannya.
-Secara umum, molekul kutub mempunyai mata mendidih dan gabungan yang tinggi.
Kekuatan ini dibentuk oleh interaksi Dipolo-dipolo, pasukan penyebaran London dan pembentukan jambatan hidrogen.
Boleh melayani anda: sulfat besi (feso4): apakah, struktur, sifat, sintesis-Oleh kerana cas elektriknya, molekul kutub dapat memacu elektrik.
Contoh
SW2
Sulfur dioksida (begitu2). Oksigen mempunyai elektronegativiti 3.44, manakala elektronegativiti sulfur adalah 2.58. Oleh itu, oksigen lebih elektronegatif daripada sulfur. Terdapat dua pautan s = o, mempunyai atau satu beban δ- dan s a beban δ+.
Kerana ia adalah molekul sudut dengan S di puncak, kedua -dua momen dipole berorientasikan ke arah yang sama; Dan oleh itu, mereka menambah, menjadikan molekul begitu2 Jadilah kutub.
Chcl3
Kloroform (HCCL3). Terdapat pautan C-H dan tiga pautan C-CL.
Elektronegativiti C ialah 2.55, dan elektronegativiti H ialah 2.2. Oleh itu, karbon lebih elektronegatif daripada hidrogen; Dan oleh itu, momen dipole akan berorientasikan dari h (δ+) ke c (δ-): cδ--Hδ+.
Dalam kes pautan C-CL, C mempunyai elektronegativiti 2.55, manakala CL mempunyai elektronegativiti 3.16. Momen dipole atau dipole berorientasikan dari c ke cl dalam tiga pautan c δ+-Cl δ-.
Apabila terdapat kawasan elektron yang lemah, di sekitar atom hidrogen, dan rantau yang kaya dengan elektron yang terdiri daripada tiga atom klorin, CHCl3 Ia dianggap sebagai molekul kutub.
Hf
Hidrogen fluorida hanya mempunyai satu ikatan H-F. Elektronegativiti H ialah 2.22 dan elektronegativiti F ialah 3.98. Oleh itu, fluorida berakhir dengan ketumpatan elektronik terbesar, dan hubungan antara kedua -dua atom digambarkan sebagai: hδ+-Fδ-.
Boleh melayani anda: aluminium hidroksida: struktur, sifat, kegunaan, risikoNH3
Ammonia (NH3) mempunyai tiga pautan N-H. Elektronegativiti N ialah 3.06 dan elektronegativiti H ialah 2.22. Dalam tiga ikatan, ketumpatan elektronik berorientasikan ke arah nitrogen, lebih besar dengan kehadiran sepasang elektron bebas.
Molekul NH3 Ia adalah tetrahedral, dengan atom n menduduki puncak. Tiga momen dipole, sepadan dengan pautan N-H, berorientasikan ke arah yang sama. Di dalamnya, δ- terletak di n, dan δ+ dalam h. Oleh itu, pautan adalah: nδ--Hδ+.
Momen -momen dipole ini, asimetri molekul, dan tork bebas elektron pada nitrogen, menjadikan ammonia molekul yang sangat kutub.
Macromolekul dengan heteroátomos
Apabila molekul sangat besar, tidak lagi tepat untuk mengklasifikasikannya sebagai apolar atau kutub dalam diri mereka. Ini kerana mungkin terdapat bahagian strukturnya dengan kedua -dua apolar (hidrofobik), seperti ciri -ciri kutub (hidrofilik).
Jenis -jenis sebatian ini dikenali sebagai amphiphilos atau amphipatic. Kerana bahagian apolar boleh dianggap miskin dalam elektron berkenaan dengan bahagian kutub, terdapat polaritas yang ada dalam struktur, dan sebatian amphiprylic dianggap sebagai sebatian kutub.
Diharapkan secara umum bahawa makromolekul dengan heteroatomes mempunyai momen dipole, dan dengan itu, polaritas kimia.
Heteroátomos difahami oleh mereka yang berbeza dari yang membentuk kerangka struktur. Sebagai contoh, kerangka berkarbonat secara biologi adalah yang paling penting dari semua, dan atom yang mempunyai pautan karbon (sebagai tambahan kepada hidrogen), ia dipanggil heteroátomo.
Rujukan
- Sebatian kutub dan nonpolar. St. Kolej Komuniti Louis. Pulih dari: pengguna.Stlcc.Edu
- Cara menjelaskan polariti. Saintifik. Pulih dari: saintifik.com

