Pemendakan kimia

- 2852
- 832
- Ms. Edgar Carroll
 Tangki pemendapan untuk rawatan air
Tangki pemendapan untuk rawatan air Apa itu pemendakan kimia?
The Pemendakan kimia Ia adalah proses rawatan air sisa di mana bahan kimia ditambah untuk mengubah ion pencemar yang dibubarkan menjadi zarah pepejal. Dalam erti kata lain, ia terdiri daripada menghasilkan zarah yang sedimen dalam air sisa dengan penambahan bahan kimia.
Objektif utama hujan kimia.
Walaupun kebanyakan bahan pencemar yang dicari untuk menghapuskan adalah logam seperti kobalt, cesium atau merkuri yang membentuk kation (ion dengan beban positif), ia juga digunakan untuk menghapuskan anion (ion dengan beban negatif) seperti fluorida, sianida dan fosfat.
Sebaik sahaja pepejal mendahului, perlu menjalankan beberapa langkah untuk dapat memisahkannya dari seluruh air. Langkah-langkah ini termasuk pemberbukuan, pemendapan dan pemisahan pepejal cecair.
Keseimbangan kelarutan dan pemendakan kimia
Teknik pemendakan kimia berdasarkan keseimbangan kelarutan sebatian ionik dan pemalar produk kelarutan. Dalam kebanyakan kes, pepejal yang mendakan adalah sedikit hidroksida larut, walaupun jenis ion lain juga dicetuskan.
Dalam semua kes pemendakan kimia, pepejal yang terbentuk adalah sebatian ionik larut sedikit yang seimbang dengan ion dalam larutan mengikut reaksi umum:
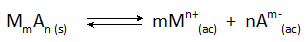
Kepekatan akhir logam, m, yang kekal dalam larutan ditentukan oleh pemalar keseimbangan tindak balas ini, serta dengan kepekatan anion, A, yang ditambah.
Sebagai contoh, Jika ia adalah hidroksida, kepekatan akhir logam akan bergantung kepada kepekatan ion hidroksida dalam larutan dan, oleh itu, dari pH.
Langkah demi langkah proses pemendakan kimia
Proses pemendakan kimia terdiri daripada empat langkah asas:
Langkah 1: Penambahan ejen precipitating dan pelarasan pH.
Ini adalah peringkat awal di mana ejen precipitating yang telah dipilih ditambah (dalam kebanyakan kes ia adalah kalsium hidroksida). PH menyesuaikan diri untuk memaksimumkan pemendakan dan mengoptimumkan kesucian akhir air.
Boleh melayani anda: Acrilonitrilo: struktur, sifat, pengeluaran, kegunaanSemasa langkah ini, campuran biasanya dipukul atau diaduk untuk memastikan kepekatan precipitating seragam.
Langkah 2: Floculation.
Tahap ini adalah untuk membolehkan pepejal kecil yang terbentuk pada peringkat pertama pemendakan untuk bergabung bersama -sama membentuk zarah atau "flocs" (oleh itu nama mereka).
Ini akan sedimen lebih cepat dalam langkah seterusnya. Untuk memihak kepada pembentukan zarah -zarah ini tanpa melanggarnya, pergolakan menjadi lebih perlahan.
Langkah 3: Pemendapan.
Ia terdiri daripada membiarkan campuran air yang baru dirawat di dalam tangki untuk membiarkan semua zarah pepejal pergi ke latar belakang (sedimen).
Langkah 4: Pemisahan pepejal-cecair.
Dalam kebanyakan kes, pemisahan pepejal-cecair terdiri daripada penyingkiran mudah air yang kekal sebagai sedimen. Dalam kes lain, pemisahan dicapai dengan penapisan atau bahkan menyentuh air yang dirawat, bergantung kepada bagaimana pencemar berbahaya.
Jenis pemendakan kimia
Hidroksida pemendakan
Ini adalah jenis pemendakan kimia yang paling biasa dan terdiri daripada peningkatan pH dengan menambahkan sebatian alkali yang hampir selalu kalsium hidroksida (CA (OH)2).
Reaksi kimia yang berlaku ialah:

Dalam reaksi sebelumnya, M mewakili sebarang kation logam yang dikehendaki untuk menghapuskan. Pepejal yang terbentuk dalam kes ini adalah hidroksida larut yang sangat sedikit.
Dalam kes pemendakan hidroksida, peraturan umum adalah bahawa semakin besar kepekatan OH- (Semakin besar pH), semakin rendah kepekatan logam yang masih ada di dalam air, setelah dirawat. Dalam erti kata lain, ke pH yang lebih besar, kesucian akhir yang lebih besar dari air.
Hujan dengan sulfida
Pemendakan kimia jenis ini digunakan terutamanya untuk penghapusan logam berat, seperti plumbum atau merkuri, dalam bentuk sulfida larut yang sangat sedikit. Untuk mencapai matlamat ini, ia boleh ditambah ke dalam air untuk merawat kedua -dua sulfida larut dan tidak larut.
Sulfida yang paling biasa digunakan adalah solubles yang termasuk hidrogen sulfida (h2S) dan natrium sulfida (na2S). Reaksi pemendakan umum ialah:
Boleh melayani anda: aloi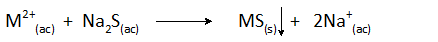
Sulfida Ferrous juga boleh ditambah yang tidak larut, tetapi menyediakan ion sulfida yang cukup untuk penyelesaian untuk mendakan sebahagian besar logam berat.
Pemendakan karbonat
Karbonat banyak logam kurang larut walaupun hidroksida dan boleh mendakan dari air kumbahan dengan menambahkan kalsium karbonat, atau mengubah hidroksida yang menggelegak karbon dioksida dalam campuran beralkali dalam campuran alkalized.
Pemendakan sianida
Tidak seperti kes -kes sebelumnya, di sini kita berusaha mendakan sianida, yang merupakan anion, bukannya logam. Cyanide adalah bahan pencemar beracun yang sangat berbahaya dan boleh dikeluarkan dari air kumbahan dengan menambahkan zink sulfat atau sulfat ferus, kerana ia membentuk kompleks dengan logam -logam ini yang mendakan.
Coprecipitation
Coprecipitation berlaku apabila larutan mendahului bersama dengan yang lain. Dalam kes ini, larutan pertama ditangkap dalam pepejal apabila mendakan sebatian lain dibentuk.
Seolah -olah pepejal ketika membentuk meninggalkan larutan pertama dan menyeretnya keluar dari penyelesaiannya. Fenomena ini digunakan untuk menghapuskan beberapa bahan pencemar yang sukar untuk mendakan diri.
Aplikasi
Pemendakan kimia digunakan dalam industri yang tidak berkesudahan untuk memenuhi keperluan alam sekitar kualiti air kumbahan.
Hidroksida pemendakan Ia digunakan dalam industri:
- Selesai logam
- Pembuatan kompaun bukan organik
- Asas
- Pembuatan bunga api dan bahan peledak
- Enamel porselin
- Perlombongan arang batu
- Industri farmaseutikal, antara lain.
Sebaliknya, Hujan dengan sulfida Ia digunakan dalam industri untuk menghapuskan bahan pencemar seperti merkuri, plumbum dan perak. Ini mempunyai aplikasi dalam industri berikut:
- Industri tekstil
- Perlombongan
- Peralatan dan bekalan fotografi
- Pembuatan logam yang tidak ferum, antara lain
Sebagai tambahan kepada industri ini, hujan adalah teknik yang paling penting untuk Pembersihan air penyejuk reaktor nuklear. Dalam industri ini, ia digunakan untuk menghapuskan kation radioaktif seperti plutonium, américo, cesio dan lain -lain.
Contoh pemendakan kimia
Hujan strontium dengan kalsium karbonat
Reaksi hujan dalam kes ini adalah:
Boleh melayani anda: nitrogen oksida (NOx)
Reaksi dilakukan ke pH optimum 10.5 dan mencapai kepekatan logam ini sehingga 100 kali lebih rendah daripada awal.
Pemendakan hidroksida antimoni
Untuk menghapuskan antimoni dari air kumbahan, titanium hidroksida boleh digunakan sebagai reagen precipitating. Tindak balasnya adalah:

Ini dijalankan dalam julat pH yang berjalan dari 5 hingga 8.5 dan juga mengurangkan kepekatan kepada nilai 100 kali kurang daripada awal.
Hujan cesium dengan tetraphenylborate
Ini adalah kes khas yang membolehkan pemendakan cessium, logam alkali sukar untuk mendakan. Tindak balasnya adalah:

Menggunakan tetraphenylborarate membawa dua manfaat yang besar: pertama, yang berfungsi secara praktikal kepada mana -mana pH (dari pH 1 hingga 13) dan kedua, bahawa kelarutan garam rendah yang dibentuk membolehkan untuk mengurangkan kepekatan akhir pencemar oleh seribu faktor seribu seribu seribu seribu seribu seribu.
Curah hujan tembaga dengan natrium sulfida
Reaksi hujan dalam kes ini adalah:
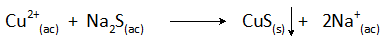
Penyingkiran tembaga air kumbahan dengan kaedah ini dijalankan pada nilai pH lebih besar daripada 8 dan kepekatannya dikurangkan sebanyak lebih daripada 99%.
Coprecipitation krom, plumbum dan zink dengan hidroksida ferrik dan aluminium hidroksida
Dalam kes ini, natrium hidroksida ditambah kepada air untuk mendakan besi dan aluminium yang terdapat dalam bentuk hidroksida ferrik (Iman (OH)3) dan aluminium hidroksida (AL (OH)3). Apabila kedua -dua hidroksida ini mendakan, mereka menyeret sebahagian daripada ion krom, plumbum dan zink. Rawatan posterior dengan hidrogen sulfida menghilangkan hampir semua tiga logam ini.
Rujukan
- Wang, l. K., Vaccari, d. Ke., Li, dan., & Shammas, n. K. (2005). Pemendakan kimia. Proses Rawatan Fisika, 141-197. Doi: 10.1385/1-59259-820-X: 141
- Striebig, b.Ke. (2005). Pemendakan kimia. Dalam ensiklopedia air (eds. J.H. Lehr dan J. Keeley). https: // doi.org/10.1002/047147844x.PC101
- Britannica, t. Editores de Encyclopaedia (2018, 8 Februari). Pemendakan kimia. Britannica Encyclopedia. https: // www.Britannica.com/sains/precipitation kimia
- D. Bhattacharyya, a. B. Jumawan jr. & R. B. Grieves (1979) Pemisahan logam berat toksik oleh Precitation Sulfide, Sains Pemisahan dan Teknologi, 14: 5, 441-452, doi: 10.1080/01496397908058096
- Marina Maya Marchioretto, Harry Bruning & Wim Rulkens (2005) Ketepatan logam berat dalam enapcemar kumbahan, Sains dan Teknologi Pemisahan, 40:16, 3393-3405, Doi: 10: 10.1080/01496390500423748

