Prinsip Le Châtelier

- 2407
- 251
- Anthony Breitenberg
Apakah prinsip Le Châtelier?
Dia Prinsip Le Châtelier Ini adalah peraturan umum yang meramalkan kesan bahawa faktor -faktor yang berbeza yang mempengaruhi keseimbangan kimia. Khususnya, ia membantu meramalkan di mana arah reaksi yang seimbang akan bergerak apabila keseimbangan tersebut terganggu oleh ejen luaran.
Prinsip ini menetapkan bahawa:
"Apabila sistem yang berada dalam keseimbangan tertakluk kepada gangguan atau ketegangan luaran, sistem bertindak balas ke arah yang membolehkannya mengatasi gangguan tersebut".
Gangguan difahami dengan baik:
- Perubahan dalam kepekatan mana -mana reagen.
- Perubahan dalam kepekatan mana -mana produk.
- Perubahan tekanan.
- Perubahan dalam jumlah.
- Perubahan suhu
Apabila perubahan berlaku seperti yang disebutkan, salah satu daripada dua reaksi, langsung atau songsang, disukai berkenaan dengan yang lain, supaya sistem bertindak balas dalam erti kata itu bergerak ke arah keadaan keseimbangan baru.
Ini serupa dengan pelarasan yang dibuat oleh pengimbang di ketat. Apabila graviti Hala di satu pihak, pengimbang bertindak balas dengan bergerak ke seberang. Kami mengatakan bahawa keseimbangannya bergerak, kerana dia masih seimbang (dia tidak jatuh), tetapi sekarang dia mempunyai kedudukan yang berbeza.
Seterusnya, kita akan melihat bagaimana prinsip le châtelier digunakan untuk meramalkan arah di mana sistem akan bertindak balas dengan mengalami pelbagai jenis ketegangan atau gangguan seperti: perubahan kepekatan, isipadu, tekanan dan suhu.
Kesan perubahan kepekatan
Katakan kita mempunyai reaksi berikut dalam keseimbangan:
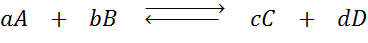
Sekiranya kita mengubah kepekatan mana -mana spesies yang terlibat (a, b, c atau d), prinsip le châtelier meramalkan bahawa sistem akan bertindak balas untuk mengatasi perubahan ini sama ada memakan kelebihan tambahan atau memulihkan jumlah yang dihapuskan. 4 situasi yang berbeza boleh diberikan:
1. Peningkatan kepekatan reagen
Sekiranya kita meningkatkan kepekatan reagen, sebagai contoh, mengikut prinsip le châtelier, sistem akan bertindak balas untuk memakan kelebihan tambahan. Ini bermakna ia akan bertindak balas secara langsung (dari kiri ke kanan), kerana arah ini dimakan.
Dalam kes ini dikatakan bahawa tindak balas langsung disukai dan baki bergerak ke arah produk, kerana dalam baki baru kepekatan produk lebih besar daripada yang dalam baki asal.
Boleh melayani anda: pemisahan magnet2. Peningkatan kepekatan produk
Sekiranya kita meningkatkan kepekatan produk, contohnya, C, sistem akan bertindak balas dengan sebaliknya untuk mengambil lebihan C ditambah (iaitu, dari kanan ke kiri).
Dalam kes ini dikatakan bahawa tindak balas terbalik disukai dan baki bergerak ke arah reagen.
3. Penurunan kepekatan reagen
Pengurangan kepekatan mempunyai kesan yang bertentangan dengan peningkatan kepekatan tersebut. Sekiranya kita menarik diri dari medium, dengan itu mengurangkan kepekatannya, sistem akan bertindak balas ke kiri (sebaliknya) untuk mengatasi perubahan. Baki bergerak ke arah reagen.
4. Penurunan kepekatan produk
Sekiranya kita mengurangkan kepekatan C atau D, sistem akan bertindak balas secara langsung untuk menggantikan kepekatan menurun (iaitu, dari kiri ke kanan). Baki bergerak ke arah produk.
Contoh:
Tentukan kesan menambahkan lebih banyak ion tiocianate (SCN-) Dalam keseimbangan kimia berikut, mengetahui bahawa produk haknya adalah merah dan besi (iii) yang sengit adalah kuning.
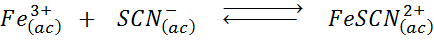
Penyelesaian: Dalam kes ini, kita menambah tiocianato yang merupakan reagen, jadi keseimbangan mesti bergerak ke kanan, meningkatkan kepekatan kompleks dan, oleh itu, intensiti warna merah dalam larutan.
Kesan perubahan jumlah dan tekanan
Perubahan dalam jumlah dan tekanan tidak menjejaskan reaksi dalam keseimbangan dalam keadaan cecair atau pepejal, tetapi mereka boleh menjejaskan yang terdapat dalam keadaan gas. Ini kerana, untuk gas, kepekatan adalah berkadar dengan tekanan, seperti yang diramalkan oleh undang -undang gas ideal.
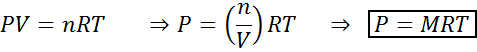
Meningkatkan tekanan gas yang mengekalkan suhu malar bersamaan dengan mengurangkan jumlahnya, jadi kesan kedua -dua gangguan akan sama.
Sekiranya tekanan total meningkat kepada tindak balas keseimbangan dalam keseimbangan (atau kita mengurangkan jumlahnya), sistem akan bertindak balas untuk mengurangkan tekanan tersebut sekali lagi, jadi baki akan bergerak ke mana terdapat jumlah molekul zarah gas yang lebih kecil.
Boleh melayani anda: kromatografi lapisan halus: ciri -ciri, apa itu Dalam tindak balas antara nitrogen dan hidrogen untuk membentuk ammonia, 4 molekul soda dimakan dan hanya dua dihasilkan, jadi peningkatan tekanan menggantikan keseimbangan ke arah pembentukan ammonia yang paling banyak
Dalam tindak balas antara nitrogen dan hidrogen untuk membentuk ammonia, 4 molekul soda dimakan dan hanya dua dihasilkan, jadi peningkatan tekanan menggantikan keseimbangan ke arah pembentukan ammonia yang paling banyak Sekiranya dalam reaksi mereka dimakan dan bilangan molekul gas yang sama dihasilkan, maka perubahan jumlah dan tekanan tidak akan menjejaskan keseimbangan.
Sebaliknya, jika kita hanya mengubah suai tekanan separa mana -mana gas, kesannya adalah sama untuk meningkatkan atau mengurangkan kepekatan spesies tersebut.
Contoh:
Memandangkan reaksi penguraian tetroksida dyitrogen secara seimbang:
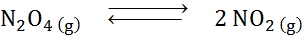
Tentukan kesan mengurangkan jumlah, meningkatkan tekanan.
Penyelesaian: Jika kita meningkatkan jumlah tekanan sistem atau mengurangkan jumlahnya, baki bergerak ke arah reagen, kerana, ke arah itu, terdapat penurunan bersih molekul gas (2 dan 1) dimakan 1) yang membolehkan untuk mengatasi peningkatan tekanan.
Kesan perubahan suhu
Kesan suhu pada keseimbangan kimia berbeza dari faktor lain yang telah kita lihat setakat ini. Dalam kes sebelumnya, baki baru diperolehi selepas gangguan, tetapi pemalar keseimbangan yang sama dikekalkan. Walau bagaimanapun, jika suhu berubah, pemalar keseimbangan akan berubah.
Untuk mengetahui bagaimana keseimbangan tetap berubah dengan suhu, tanda entalpi reaksi perlu diketahui:
- Jika tindak balas melepaskan haba, iaitu, ia adalah eksotermik, entalpinya negatif, dan pemalar keseimbangan berkurangan apabila suhu meningkat. Dalam kes ini, keseimbangan bergerak ke arah yang bertentangan ke arah reagen.
- Sekiranya tindak balas menyerap haba, iaitu, endotermik, entalpinya positif dan sebaliknya berlaku.
Mengingat kesan suhu adalah mudah jika kita menganggap haba sebagai reagen yang berlaku dalam kes reaksi eksotermik dan dimakan dalam hal endotermik. Peningkatan suhu akan seperti "tambah" haba ke sistem dan menyejukkannya akan bersamaan dengan membuangnya.
Jadi, jika tindak balas adalah eksotermik dan suhu meningkat, ia akan menjadi seperti menambahkan produk tindak balas, jadi baki bergerak ke arah yang bertentangan, ke arah reagen, dan jika ia menyejukkan yang bertentangan.
Ia dapat melayani anda: asid píchric: apakah, struktur, sintesis, sifatSebaliknya, jika tindak balas endotermik dan suhu meningkat, ia akan menjadi seperti menambah reagen, jadi baki bergerak ke arah produk, sementara penurunan suhu mempunyai kesan yang bertentangan.
Contoh:
Tindak balas penguraian n2Sama ada4 Ia mempunyai entalpi reaksi +58.0 kJ/mol. Ke arah mana keseimbangan akan bergerak jika suhu berkurangan?
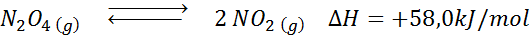
Penyelesaian: Seperti entalpi positif, tindak balas adalah endotermik. Atas sebab ini, penyejukan ia akan memihak kepada tindak balas terbalik, dan keseimbangan akan bergerak ke arah reagen, iaitu, ke arah pembentukan lebih banyak n2Sama ada4.
Kesan pemangkin, inhibitor dan bahan lengai
Pemangkin dan inhibitor mempengaruhi kelajuan yang berlaku, tetapi ia mempengaruhi tindak balas langsung dan tidak langsung. Atas sebab ini, mereka tidak menjejaskan keadaan keseimbangan.
Sebaliknya, penambahan bahan lengai sebagai gas yang tidak bertindak balas dengan mana -mana reagen atau produk, tidak akan menjejaskan tindak balas langsung atau langsung, jadi ia akan memberi kesan kepada baki.
Permohonan prinsip Le Châtelier
Memahami prinsip ini sangat berguna, kerana ia membolehkan kita memanipulasi keadaan keseimbangan reaksi terhadap kemudahan kita.
Dalam kes -kes di mana kita berminat.
Ini bermaksud:
- Masukkan sejumlah besar reagen, jika ini ekonomi.
- Menarik balik produk apabila reaksi berlangsung, untuk mengekalkan sistem dalam keadaan voltan yang berterusan, sentiasa berusaha untuk mencapai keseimbangan yang bertindak balas secara langsung.
- Meningkatkan suhu dalam kes tindak balas endotermik.
- Meningkatkan tekanan ke atas tindak balas di mana lebih banyak molekul gas dimakan daripada yang berlaku.
Kami juga mungkin mahu meminimumkan jumlah produk yang dibentuk oleh reaksi yang tidak diingini. Dalam kes ini kita melakukan sebaliknya.
Contoh permohonan Prinsip Le Châtelier
Dalam sintesis organik, prinsip le châtelier sentiasa digunakan untuk meningkatkan hasil reaksi.
Sebagai contoh, dalam tindak balas dehidrasi alkohol, desiccants ditambah kepada persekitaran yang menyerap air yang terbentuk semasa reaksi. Ini mengurangkan kepekatan produk tersebut, yang menggantikan keseimbangan ke arah produk.

