Apa itu kinetik kimia?

- 4687
- 739
- Ms. Micheal Rippin
Kami menerangkan apakah kinetik kimia, pesanan dan kelajuan tindak balas, dan faktor -faktor yang mempengaruhi kelajuan
Apa itu kinetik kimia?
The Kinetik kimia Adalah cabang kimia yang bertanggungjawab untuk mengkaji kelajuan tindak balas kimia, faktor -faktor yang mempengaruhi kelajuan ini dan apakah mekanisme atau langkah individu di mana reaksi kimia berlaku.
Di samping itu, ia membolehkan kita memahami banyak aspek tindak balas kimia seperti keseimbangan kimia dan tenaga pengaktifan, dan kajian proses pemangkinan. Yang terakhir menjadikannya sangat penting dalam pelbagai aplikasi, dari biokimia hingga kejuruteraan industri.
Di tengah kinetik adalah kelajuan tindak balas, yang dapat difahami sebagai kadar di mana reagen berubah menjadi produk. Walau bagaimanapun, dalam kinetik kimia terdapat definisi yang lebih tepat.
Definisi kelajuan tindak balas
Untuk memberikan definisi lengkap kelajuan tindak balas, seperti yang digunakan dalam kinetik kimia, mari kita mulakan dengan reaksi kimia generik berikut:
Dalam tindak balas ini, A dan B mewakili reagen, C dan D mewakili produk, sementara A, B, C dan d Mereka mewakili pekali stoikiometrik masing -masing.
Kadar tindak balas (diwakili dengan simbol v) Menunjukkan seberapa cepat. Secara matematik, ini dinyatakan seperti berikut:
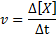
Di mana δ [x] mewakili perubahan kepekatan molar spesies x (a, b, c atau d) dalam selang waktu Δt.
Jelas bahawa semakin cepat mana -mana reagen dimakan, semakin cepat reagen lain akan dimakan dan semakin cepat produk akan berlaku. Atas sebab ini, hanya perlu untuk menentukan kelajuan dari segi salah satu daripada mereka.
Ia dapat melayani anda: Kaedah pemisahan campuran homogenUntuk memastikan bahawa hasil pengiraan kelajuan selalu sama, tanpa mengira spesies mana kelajuan ditakrifkan, ia mesti sentiasa dibahagikan antara pekali stoikiometrik dan meletakkan tanda kurang sebelum persamaan jika ia adalah reagen. Iaitu:
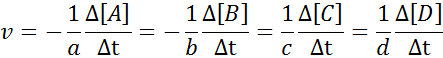
Contoh Definisi Kelajuan Reaksi
Memandangkan tindak balas kimia berikut:
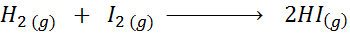
Tulis definisi kelajuan tindak balas bergantung pada setiap spesies yang terlibat.
Penyelesaian:
Dari segi h2:
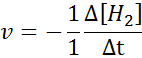
Dari segi i2:
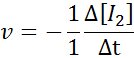
Dari segi hi:
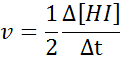
Undang -undang Kelajuan dan Perintah Reaksi
Reaksi berlaku apabila atom dan molekul bertabrakan antara satu sama lain dengan tenaga yang mencukupi dan orientasi yang betul. Kebarangkalian bahawa ini berlaku meningkat apabila atom dan molekul lebih tertumpu.
Atas sebab ini, kelajuan hampir selalu bergantung pada kepekatan reagen. Dalam sesetengah kes, kelajuan juga bergantung kepada kepekatan mana -mana produk, serta kepekatan mana -mana pemangkin atau perencat yang terdapat di alam sekitar.
Persamaan matematik yang mengaitkan kelajuan tindak balas terhadap kepekatan spesies yang berbeza yang dipanggil "Undang -undang kelajuan"Dan, dalam kes yang lebih mudah, ia mempunyai bentuk berikut:
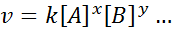
Di mana k Ia adalah pemalar berkadar yang dipanggil Kelajuan berterusan, dan eksponen A, B dan mana -mana spesies lain yang muncul dalam persamaan, dipanggil Perintah tindak balas.
Mengikut jumlah semua pesanan tindak balas (yang dipanggil perintah global), pelbagai jenis tindak balas dapat dibezakan. Ini berbeza dari berapa banyak kepekatan mempengaruhi kelajuan, dalam formula masa yang diperlukan untuk mengambil separuh daripada reagen (separuh hayat) dan dalam cara kepekatan reagen berubah dari masa ke masa (graf [a] vs t ).
-
Reaksi pesanan 0
Apabila semua eksponen dalam undang -undang kelajuan adalah 0, persamaan undang -undang kelajuan dikurangkan kepada:
Boleh melayani anda: Pautan kovalen yang diselaraskan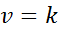
Dalam erti kata lain, mereka adalah tindak balas yang berlaku pada kelajuan tetap dan di mana kelajuan tidak bergantung pada kepekatan mana -mana reagen atau produk.
Pesanan graf 0
Grafik [a] vs t tindak balas pesanan 0 adalah garis lurus menurun.
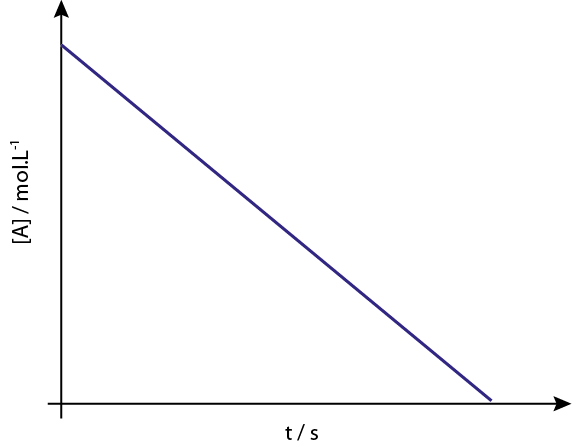
Legenda: Grafik Konsentrasi Vs Masa Reaksi Pesanan 0 memberikan garis lurus.
Kehidupan Tengah untuk Pesanan 0
Untuk reaksi pesanan 0, masa separuh kehidupan (t1/2) Diberikan oleh:
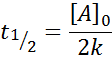
-
Reaksi pesanan pertama
Dalam tindak balas ini kelajuan berbeza secara linear dengan kepekatan. Undang -undang kelajuan pesanan pertama adalah:
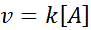
Grafik pesanan pertama
Grafik [a] vs t tindak balas pertama adalah hiperbola menurun. Walau bagaimanapun, jika logaritma neperian kepekatan (ln [a]) vs masa adalah graf, garis lurus diperolehi.
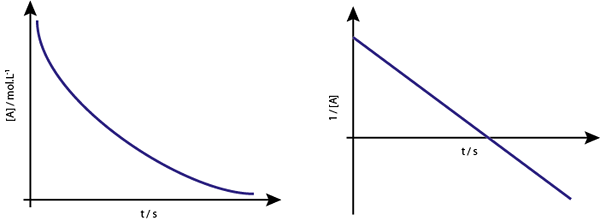 Grafik kepekatan berbanding masa tindak balas urutan 1 memberikan hiperbola, tetapi graf logaritma neperian kepekatan berbanding masa memberi garis
Grafik kepekatan berbanding masa tindak balas urutan 1 memberikan hiperbola, tetapi graf logaritma neperian kepekatan berbanding masa memberi garis Kehidupan Tengah untuk Reaksi Pertama
Untuk tindak balas pesanan 1, t1/2 Ia tidak bergantung pada kepekatan awal dan diberikan oleh:
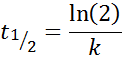
-
Tindak balas pesanan kedua
Tindak balas boleh menjadi urutan kedua berkenaan dengan satu reagen tunggal, atau perintah pertama berkenaan dengan dua reagen. Dalam kes pertama, undang -undang kelajuan diberikan oleh:
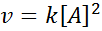
Grafik pesanan kedua
Grafik [a] vs t tindak balas kedua adalah hiperbola menurun. Walau bagaimanapun, jika kebalikan dari kepekatan (1/[a]) vs masa diplot, garis lurus diperolehi.
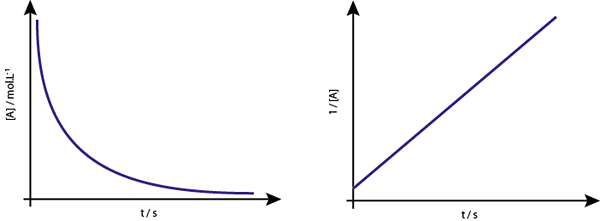 Grafik kepekatan berbanding masa tindak balas pesanan 2 memberikan lengkung yang serupa dengan hiperbola menurun, tetapi graf kepekatan berbanding masa memberi garis
Grafik kepekatan berbanding masa tindak balas pesanan 2 memberikan lengkung yang serupa dengan hiperbola menurun, tetapi graf kepekatan berbanding masa memberi garis Kehidupan Tengah untuk Reaksi Pesanan Kedua
Untuk tindak balas pesanan 2, t1/2 Diberikan oleh:
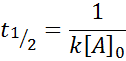
Faktor yang mempengaruhi kelajuan tindak balas
Suhu
Suhu sentiasa meningkatkan kelajuan di mana tindak balas berlaku, kerana kekerapan dan tenaga yang mana molekul bertabrakan antara satu sama lain meningkat. Ketergantungan pada kelajuan tindak balas dengan suhu diberikan oleh persamaan Arrhenius.
Ia boleh melayani anda: Magnesium Hidrida: Struktur, Hartanah dan KegunaanTekanan
Tekanan yang semakin meningkat bersamaan dengan meningkatkan kepekatan semua spesies dalam medium tindak balas (untuk tindak balas fasa gas), jadi tekanan meningkat cenderung meningkatkan kelajuan reaksi.
Pemangkin
Pemangkin adalah bahan kimia yang ditambah ke medium hanya untuk meningkatkan kelajuan tindak balas. Kebanyakan pemangkin berfungsi dengan mengubah mekanisme tindak balas oleh satu yang memerlukan tenaga pengaktifan yang lebih rendah.
Contoh pemangkin biasa adalah enzim dalam sistem hidup dan beberapa logam seperti platinum dan paladium.
Perencat
Inhibitor adalah kebalikan dari pemangkin. Mereka adalah bahan yang membuat reaksi lebih perlahan. Anticorrosif adalah contoh perencat yang berusaha mengurangkan kelajuan reaksi kakisan, untuk menjadikan permukaan logam lebih banyak.


