Apakah anod dan katod?

- 4308
- 1209
- Donnie Ryan
Dia anod dan katod Mereka adalah jenis elektrod yang terdapat dalam sel elektrokimia. Ini adalah peranti yang mampu menghasilkan elektrik melalui tindak balas kimia. Sel elektrokimia yang paling banyak digunakan adalah bateri.
Terdapat dua jenis sel elektrokimia, sel elektrolitik dan sel galvanik atau voltan. Dalam sel -sel elektrolitik, tindak balas kimia yang dihasilkan oleh tenaga tidak berlaku secara spontan, tetapi arus elektrik berubah menjadi tindak balas pengoksidaan kimia.

Sel galvanik terdiri daripada dua separuh. Ini dihubungkan dengan dua elemen, pemandu logam dan jambatan garam.
Konduktor elektrik, seperti yang ditunjukkan oleh namanya, mengetuai elektrik kerana dia mempunyai ketahanan yang sangat sedikit terhadap pergerakan caj elektrik. Pemandu terbaik biasanya logam.
Jambatan Saline adalah tiub yang menghubungkan kedua -dua separa, sambil mengekalkan hubungan elektrik mereka, dan tanpa membiarkan komponen setiap sel bergabung.Setiap separuh daripada sel galvanik mengandungi elektrod dan elektrolit.
Apabila tindak balas kimia berlaku, salah satu daripada separuh -llads kehilangan elektron ke elektrodnya, melalui proses pengoksidaan; Walaupun yang lain memenangi elektron untuk elektrod, melalui proses pengurangan.
Proses pengoksidaan dihasilkan dalam anod, dan proses pengurangan dalam katod
[TOC]
Anod
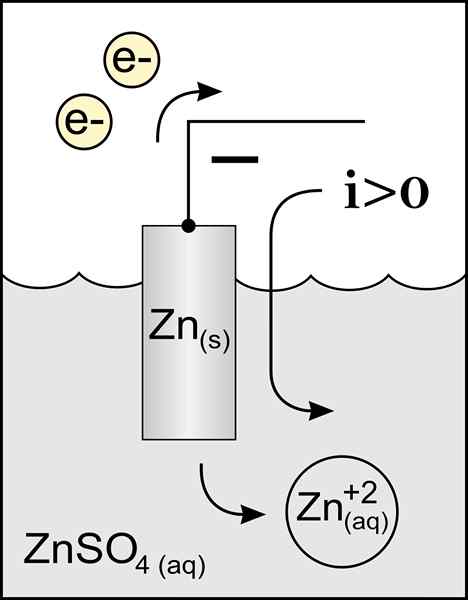 Diagram anod zink dalam sel voltan. Sumber: Kerja Asal: Fail: Anod Zink 2.PNG oleh Pengguna: Micheljullian (bercakap) Kerja Derivatif: Kes47/CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/)
Diagram anod zink dalam sel voltan. Sumber: Kerja Asal: Fail: Anod Zink 2.PNG oleh Pengguna: Micheljullian (bercakap) Kerja Derivatif: Kes47/CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/) Nama anod berasal dari Yunani ανά (aná): up, dan οδός (odós): jalan. Faraday adalah orang yang mencipta istilah ini pada abad kesembilan belas.
Anod yang terbaik adalah elektrod yang kehilangan elektron dalam tindak balas pengoksidaan. Biasanya ia dikaitkan dengan tiang positif transit arus elektrik, tetapi tidak selalu berlaku.
Boleh melayani anda: penyelesaian yang dihargaiWalaupun di dalam bateri anod adalah tiang positif, di lampu LED ia sebaliknya, anod menjadi tiang negatif.
Biasanya rasa arus elektrik ditakrifkan, menghargainya sebagai rasa beban bebas, tetapi jika pemandu tidak logam, caj positif yang dihasilkan dipindahkan ke pemacu luaran.
Pergerakan ini menunjukkan bahawa kita mempunyai caj positif dan negatif yang bergerak dalam deria yang bertentangan, jadi dikatakan bahawa arah arus adalah laluan caj positif kation yang ada di anod ke arah beban negatif anod Anod yang terdapat di katod.
Dalam sel -sel galvanik, mempunyai konduktor logam, arus yang dihasilkan dalam reaksi tidak mengikuti jalan dari tiang positif ke negatif.
Tetapi dalam sel elektrolitik, tidak mempunyai konduktor logam, tetapi elektrolit, ion dengan beban positif dan negatif yang bergerak dalam deria bertentangan boleh didapati.
Anod thermoionik menerima sebahagian besar elektron yang datang dari katod, panaskan anod dan perlu mencari jalan untuk menghilangkan. Haba ini dihasilkan dalam ketegangan yang berlaku di antara elektron.
Anod khas
Terdapat sejenis anod khas, seperti yang ada dalam x -rays. Di dalam tiub ini, tenaga yang dihasilkan oleh elektron, selain menghasilkan x -rays, menghasilkan tenaga yang hebat yang memanaskan anod.
Panas ini berlaku kepada ketegangan yang berbeza antara kedua -dua elektrod dan yang memberi tekanan pada elektron. Apabila elektron bergerak dalam arus elektrik, mereka memukul anod dengan menghantar haba mereka.
Boleh melayani anda: Persamaan Henderson-Haselbalch: Penjelasan, Contoh, LatihanKatod
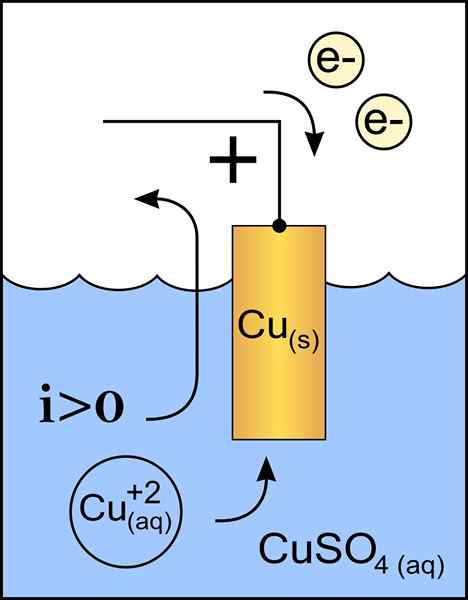 Rajah katod tembaga dalam sel voltan. Sumber: Kerja Asal: Fail: Anod Zink 2.PNG oleh Pengguna: Micheljullian (bercakap) Kerja Derivatif: Kes47/CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/)
Rajah katod tembaga dalam sel voltan. Sumber: Kerja Asal: Fail: Anod Zink 2.PNG oleh Pengguna: Micheljullian (bercakap) Kerja Derivatif: Kes47/CC BY-S (http: // creativeCommons.Org/lesen/by-sa/3.0/) Katod adalah elektrod dengan beban negatif, yang dalam tindak balas kimia mengalami tindak balas pengurangan, di mana status pengoksidaannya dikurangkan apabila ia menerima elektron.
Seperti anod, Faraday yang mencadangkan istilah katod yang berasal dari bahasa Yunani κατά [Catá]: 'turun', dan ὁδός [odós]: 'jalan'. Ke elektrod ini, beban negatif dikaitkan dari masa ke masa.
Pendekatan ini palsu, kerana bergantung pada peranti di mana ia terletak, ia mempunyai beban atau yang lain.
Hubungan ini dengan tiang negatif, seperti anod, timbul dari anggapan bahawa arus mengalir dari tiang positif ke negatif. Ini timbul di dalam sel galvanik.
Di dalam sel -sel elektrolitik, cara pemindahan tenaga, kerana ia tidak berada dalam logam tetapi dalam elektrolit, boleh wujud bersama ion negatif dan positif yang bergerak dalam deria bertentangan. Tetapi dengan persetujuan, dikatakan bahawa arus pergi dari anod ke katod.
Katod khas
Jenis katod tertentu adalah katod termonik. Dalam hal ini, katod memancarkan elektron kerana kesan haba.
Dalam injap thermionic, katod boleh memanaskan diri dengan mengedarkan arus pemanasan dalam filamen yang telah ditambah dengannya.
Reaksi keseimbangan
Sekiranya kita mengambil sel galvanik, yang merupakan sel elektrokimia yang paling biasa, kita dapat merumuskan reaksi keseimbangan yang dihasilkan.
Setiap semi -media yang membentuk sel galvanik, mempunyai ketegangan ciri yang dikenali sebagai potensi pengurangan. Dalam setiap separuh -dubur terdapat tindak balas pengoksidaan antara ion yang berbeza.
Boleh melayani anda: spektrum penyerapanApabila tindak balas ini mencapai keseimbangan, sel tidak dapat memberikan ketegangan lebih banyak. Pada masa ini, pengoksidaan yang berlaku di separuh masa itu akan mempunyai nilai positif yang lebih dekat adalah baki. Potensi tindak balas akan lebih besar lebih banyak keseimbangan yang dicapai.
Apabila anod seimbang, ia mula kehilangan elektron yang melewati pemandu ke katod.
Di dalam katod reaksi pengurangan berlaku, semakin banyak keseimbangan yang paling berpotensi akan mempunyai reaksi ketika menghasilkan dan mengambil elektron yang datang dari anod.
Rujukan
- Huheey, James dan., et al.Kimia bukan organik: Prinsip struktur dan kereaktifan. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Kimia: Prinsip dan sifat. New York, AS: McGraw-Hill, 1966.
- Brady, James dan.Kimia Umum: Prinsip dan Struktur. Wiley, 1990.
- Petrucci, Ralph H., et al.Kimia Am. Dana Pendidikan Inter -American, 1977.
- Masterton, William L.; Hurley, Cecile N.Kimia: Prinsip dan tindak balas. Pembelajaran Cengage, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Reaksi elektrokimia. Toray-Masson, 1969.

