Radikal menyewa bagaimana mereka membentuk, tatanama, contoh

- 648
- 157
- Mr. Tracy Parisian
The Sewa radikal Mereka adalah satu set molekul yang tidak stabil yang berasal dari kehilangan hidrogen alkane. Mereka dicirikan dengan mempunyai elektron yang hilang, jadi mereka bertindak balas dengan cepat untuk menyelesaikan oktet valencia atom di mana ia berada.
Radikal ini dilambangkan dengan huruf r, seperti kumpulan sewa, tetapi dengan perbezaan titik ditambah, r ·. Titik ini menunjukkan kehadiran elektron hilang. Sebagai contoh, pertimbangkan gas metana, CHO4. Alkane ini, kehilangan salah satu hidrogennya, akan diubah menjadi metil radikal, CHO3· (Gambar di bawah).
 Formula umum alkil radikal dan metil radikal. Sumber: Gabriel Bolívar melalui Molview.
Formula umum alkil radikal dan metil radikal. Sumber: Gabriel Bolívar melalui Molview. Sekiranya anda ingin memperdalam sedikit mengenai struktur radikal CH3·, Akan dilihat bahawa elektron yang hilang berada pada sudut tegak lurus dengan pautan C-H; iaitu, ia terletak di orbital p Murni. Oleh itu, Cho3· Mengamalkan hibridisasi SP2, serta, secara amnya, dengan alkil radikal lain.
Radikal ini adalah asas tindak balas rantai di mana alkana mengambil bahagian, seperti halnya halogenasi mereka: klorinasi, bromasi, dll. Terdapat radikal ke -1, ke -2 dan ke -3, serta vinil dan alilic, masing -masing dengan kestabilan masing -masing dan kemudahan latihan.
[TOC]
Bagaimana radikal terbentuk alkil?
Reaksi "mudah" yang radikal terbentuk adalah halogenasi alkana. Untuk membentuk, tindak balas rantai mesti diberikan, yang hanya berlaku pada suhu tinggi (melebihi 250 ºC), atau di bawah kejadian cahaya ultraviolet pada suhu bilik.
Boleh melayani anda: natrium sulfit (na2SO3)Pertimbangkan pengklorinan metana di bawah salah satu syarat yang disebutkan di atas:
Cl2 → 2cl ·
Tenaga yang disediakan sudah cukup untuk memecahkan pautan CL-CL molekul klorin, yang mengalami rehat homolitik; iaitu, setiap atom klorin kekal dengan salah satu elektron pautan. Oleh itu, dua radikal terbentuk.
Kemudian, cl radikal menyerang molekul metana:
Cl · + ch4 → HCl + CH3·
Dan metil radikal muncul. CH ini3· Ia agak tidak stabil, jadi ia akan bertindak balas dengan segera untuk memenangi elektron tambahan yang akan muncul elektron tunggalnya:
Ch3· + Cl2 → Ch3Cl + cl ·
Yang terbentuk akan bertindak balas dengan molekul metana yang lain dan kitaran akan diulang lagi dan lagi. Apabila metana habis, tindak balas berikut akan berlaku yang akan menamatkan reaksi rantai:
Cl · + · cl → cl2
Ch3· + · Cho3 → Ch3Ch3
Ch3· + · Cl → CH3Cl
Kestabilan relatif
Ch3
Metana bukan satu -satunya alkana yang "radikal" oleh pengklorinan. Ia juga berlaku sama dengan etana, propana, butana, dan isomer lain. Walau bagaimanapun, apa yang berbeza adalah tenaga yang diperlukan yang mesti disediakan supaya radikal cl · dehidrogat molekul alkana. Sekiranya berlaku radikal metil, ia sangat tidak stabil dan, oleh itu, sukar untuk dibentuk.
Oleh itu, cho radikal3Ch2· Ia lebih stabil dan mudah dibentuk daripada Cho3·. Kerana? Kerana ch radikal3Ch2· Ia adalah utama, 1, yang bermaksud bahawa elektron yang hilang berada pada atom karbon yang dikaitkan dengan karbon lain. Sementara itu, Cho3Sebaik sahaja ia dikaitkan dengan atom hidrogen.
Boleh melayani anda: fluorida: sejarah, sifat, struktur, mendapatkan, risiko, kegunaanApa ini? Mengingat perwakilan sebelumnya, elektron yang hilang terletak di orbital p, tegak lurus dengan pautan lain. Dalam ch3·, Atom hidrogen hampir tidak menyumbangkan ketumpatan elektronik ke atom karbon, dalam usaha untuk mengimbangi kekurangan elektron lain.
1st
Dalam ch3Ch2·, Sebaliknya, karbon dengan elektron yang hilang dikaitkan dengan dua hidrogen dan kumpulan metil. Oleh itu, karbon ini menerima ketumpatan elektronik yang lebih besar, yang membantu menstabilkan elektron hilang sedikit. Penjelasan yang sama sah untuk radikal alkynd 1 yang lain.
2
Dalam radikal sekunder atau 2nd alquil, seperti radikal isopropil, (CH3)2C. Oleh itu, ia lebih stabil daripada radikal 1 dan metil.
Ke -3
Kami juga mempunyai radikal alkynd tertiari atau ke-3, seperti radikal ter-butil3)3C ·. Ini lebih stabil daripada yang pertama dan ke -2. Sekarang, terdapat tiga kumpulan berkarbonat yang berbeza dari atom hidrogen yang menstabilkan elektron yang hilang.
Allylic dan vinil
Ia juga bernilai menyebut radikal allylic, CHO2= Ch-ch2·, Dan vinil, CHO2= Ch ·.
Alilic adalah yang paling stabil dari semua. Ini kerana elektron yang hilang bahkan mampu bergerak ke atom karbon pada hujung yang lain. Vínilico, sebaliknya, adalah yang paling tidak stabil dari semua, kerana kumpulan Cho2=, lebih banyak asid, menarik ketumpatan elektronik ke arah dirinya dan bukannya mendermakannya ke arah karbon dengan elektron hilang.
Boleh melayani anda: memimpin hidroksida: struktur, sifat, kegunaan, risikoRingkasnya, kestabilan relatif radikal alkynd, dari tertinggi hingga terendah, adalah:
Alilo> 3> 2> 1st> vinil
Nomenclature
Nomenklatur radikal alkil adalah sama dengan remedie. Oleh itu, Cho3Ch2· Dipanggil etil radikal; dan ch radikal3Ch2Ch2Ch3, n-butil.
Sewa radikal utama
Radikal alkil utama bertepatan dengan kumpulan alkil: mereka adalah mereka yang mempunyai kurang dari enam atom karbon. Oleh itu, radikal berasal dari metana, etana, propana, butana dan pentano, adalah yang paling biasa. Begitu juga, vinil radikal dan alilicos adalah sebahagian daripada senarai ini.
Radikal alkynd lain yang didapati kurang kerap adalah yang berasal dari sikloalcanos, seperti siklobutane, siklobutane atau cyclopentano.
Dalam imej berikut, beberapa radikal ini diwakili dengan huruf yang diberikan:
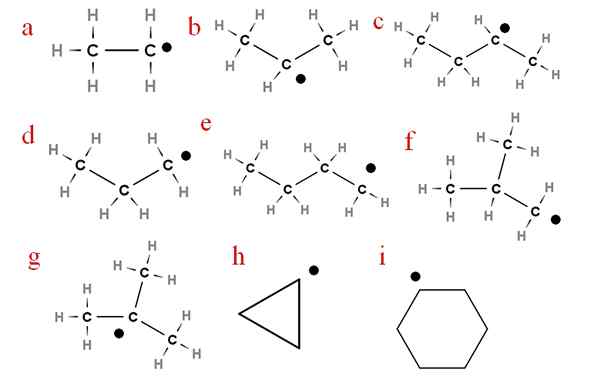 Sembilan radikal alkali yang paling penting. Sumber: Gabriel Bolívar.
Sembilan radikal alkali yang paling penting. Sumber: Gabriel Bolívar. Bermula dengan huruf 'A', kita ada:
-a, etil radikal
-B, isopropil radikal
-C, Secbutyl Radikal
-D, propil radikal
-E, radikal n-butil
-F, Isobutil Radikal
-G, ter-butil radikal
-H, cycropilus radikal
-Saya, Cyclohexil Radikal
Setiap radikal ini mungkin atau mungkin tidak mempunyai hidrogen mereka digantikan oleh kumpulan lain, jadi mereka sama -sama diubah sebagai alkana dan isomer struktur mereka.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Alkil. Diperoleh dari: dalam.Wikipedia.org
- Kimia Librettexts. (5 Jun, 2019). Struktur radikal alkil: hyperconjugation. Pulih dari: chem.Libretxts.org

