Ciri Reaksi Kimia, Bahagian, Jenis, Contoh

- 719
- 87
- Mr. Tracy Parisian
The tindak balas kimia Mereka adalah perubahan yang berlaku dalam pesanan atom mereka, dan berlaku apabila dua bahan atau sebatian yang berbeza dapat dihubungi. Dalam proses perubahan yang dapat dilihat dengan segera; seperti peningkatan suhu, penyejukan, pembentukan gas, berkelip atau pemendakan pepejal.
Reaksi kimia yang paling biasa sering tidak disedari dalam kehidupan seharian; Beribu -ribu dari mereka dijalankan di badan kita. Walau bagaimanapun, yang lain lebih kelihatan, kerana kita boleh melaksanakannya di dapur dengan memilih peralatan dan bahan yang betul; Contohnya, campurkan bikarbonat dengan cuka, gula melter di dalam air atau mengasingkan jus colorad.
 Reaksi bikarbonat dan cuka adalah contoh tindak balas kimia berulang di dapur. Sumber: Kate Ter Har (https: // www.Flickr.com/foto/Katha/5703151566)
Reaksi bikarbonat dan cuka adalah contoh tindak balas kimia berulang di dapur. Sumber: Kate Ter Har (https: // www.Flickr.com/foto/Katha/5703151566) Di makmal, tindak balas kimia menjadi lebih biasa dan biasa; Semuanya berlaku di dalam bikar (bikar), atau erlenmeyer. Jika mereka berkongsi persamaan, tidak ada yang mudah, kerana mereka menyembunyikan perlanggaran, rehat pautan, mekanisme, pembentukan pautan, tenaga dan aspek kinetik.
Terdapat tindak balas kimia yang begitu menarik bahawa peminat dan saintis, mengetahui toksikologi reagen dan beberapa langkah keselamatan, menghasilkan semula mereka pada skala besar dalam tindakan demonstrasi menarik.
[TOC]
Konsep tindak balas kimia
Reaksi kimia berlaku apabila terdapat pemecahan pautan (ionik atau kovalen), supaya yang lain terbentuk di tempatnya; Dua atom atau satu set mereka berhenti berinteraksi dengan kuat untuk menyebabkan molekul baru. Terima kasih kepada ini, sifat kimia sebatian, kereaktifan, kestabilan, dengan apa yang ia dapat ditentukan.
Di samping bertanggungjawab, tindak balas kimia bahawa perkara itu sentiasa berubah, tanpa atom mereka, mereka menjelaskan kemunculan sebatian seperti yang kita tahu.
Untuk pautan yang akan dipecahkan, tenaga diperlukan, dan apabila pautan dibentuk, ia dikeluarkan. Sekiranya tenaga yang diserap lebih besar daripada yang dikeluarkan, dikatakan bahawa reaksi adalah endothermal; Kami mempunyai penyejukan sekitar. Walaupun jika haba yang dikeluarkan adalah lebih baik daripada menyerap, maka ia akan menjadi reaksi eksotermik; Persekitaran dipanaskan.
Ciri -ciri tindak balas kimia
Kinetik
Molekul teori mesti bekerjasama antara satu sama lain, membawa mereka tenaga kinetik yang cukup untuk memihak kepada pemecahan pautan. Sekiranya perlanggaran anda lambat atau tidak cekap, tindak balas kimia terjejas secara kinetik. Ini mungkin berlaku sama ada oleh keadaan fizikal bahan, atau oleh geometri atau struktur yang sama.
Oleh itu, dalam tindak balas perkara itu diubah dengan menyerap atau melepaskan haba, sementara penderitaan perlanggaran yang memihak kepada pembentukan produk; Komponen terpenting dari sebarang reaksi kimia.
Pemuliharaan massa
Oleh kerana undang -undang pemuliharaan massa, jumlah jisim set tetap malar selepas tindak balas kimia. Oleh itu, jumlah jisim individu setiap bahan adalah sama dengan jisim hasil yang diperolehi.
Perubahan fizikal dan/atau perubahan keadaan
Kejadian tindak balas kimia boleh disertakan dengan perubahan keadaan komponen; iaitu, variasi keadaan pepejal, cecair atau gas dari bahan.
Walau bagaimanapun, tidak semua perubahan dalam keadaan menyiratkan tindak balas kimia. Contohnya: Jika air menguap akibat haba, wap air yang dihasilkan selepas perubahan keadaan ini kekal air.
Variasi warna
Antara sifat fizikal yang disebabkan oleh tindak balas kimia, perubahan warna reagen berbanding warna produk akhir menonjol.
Fenomena ini cukup ketara apabila memerhatikan tindak balas kimia logam dengan oksigen: apabila logam dioksidakan, ia mengubah warna ciri (emas atau perak, seperti yang mungkin), untuk menjadi nada oren-reddish, yang dikenali sebagai karat.
Pelepasan gas
Ciri ini ditunjukkan sebagai menggelegak atau dengan pelepasan bau tertentu.
Umumnya, gelembung muncul sebagai hasil penyerahan cecair pada suhu tinggi, yang menggalakkan peningkatan tenaga kinetik molekul yang merupakan sebahagian daripada reaksi.
Perubahan suhu
Sekiranya haba adalah pemangkin tindak balas kimia, perubahan suhu akan diinduksi dalam produk akhir. Oleh itu, kemasukan haba dan keluar dalam proses juga boleh menjadi ciri tindak balas kimia.
Bahagian reaksi kimia
Reagen dan produk
Sebarang tindak balas kimia diwakili oleh persamaan jenis:
A + b → c + d
Di mana a dan b adalah reaktan, manakala c dan d produk. Persamaan memberitahu kita bahawa atom atau molekul A, bertindak balas dengan b untuk menyebabkan produk c dan d. Ini adalah tindak balas yang tidak dapat dipulihkan, kerana reaktan tidak boleh berasal dari produk. Sebaliknya, tindak balas di bawah boleh diterbalikkan:
A + b c + d
Adalah penting untuk menekankan bahawa jisim reaktan (a+b) mestilah sama dengan jisim produk (c+d). Jika tidak, doh tidak akan dipelihara. Begitu juga, bilangan atom untuk elemen tertentu mestilah sama sebelum dan selepas anak panah.
Di atas anak panah menunjukkan beberapa spesifikasi tindak balas: suhu (δ), kejadian radiasi ultraviolet (Hv), atau pemangkin yang digunakan.
Boleh melayani anda: gelas jamReaksi bermakna
Berkenaan dengan kehidupan dan tindak balas yang berlaku di dalam badan kita, medium reaksi berair (AC). Walau bagaimanapun, tindak balas kimia boleh dibangunkan dalam mana -mana medium cecair (etanol, asid asetik glasier, toluena, tetrahydrofuran, dll.) selagi reagen dibubarkan dengan baik.
Bekas atau reaktor
Reaksi kimia terkawal berlaku di dalam bekas, sama ada bahan kaca mudah, atau dalam reaktor keluli tahan karat.
Jenis tindak balas kimia
Jenis tindak balas kimia adalah berdasarkan apa yang berlaku di peringkat molekul; Apa pautan pecah dan bagaimana atom akhirnya bergabung. Ia juga dipertimbangkan sama ada spesies memperoleh atau kehilangan elektron; Walaupun ini berlaku dalam kebanyakan tindak balas kimia.
Berikut adalah pelbagai jenis tindak balas kimia yang wujud.
- Pengurangan pengoksidaan (Rédox)
Pengoksidaan tembaga
Dalam contoh patina, tindak balas pengoksidaan berlaku: tembaga logam kehilangan elektron dengan kehadiran oksigen untuk berubah menjadi oksida yang sepadan.
4cu (s) + o2(g) => cu2Anda)
Tembaga oksida (i) terus mengoksida untuk memberikan tembaga oksida (ii):
2cu2Atau (s) + atau2 => 4Cuo (s)
Jenis tindak balas kimia ini di mana spesies meningkatkan atau mengurangkan nombor pengoksidaan (atau status), dikenali sebagai tindak balas pengoksidaan dan pengurangan (Rédox).
Tembaga logam dengan keadaan pengoksidaan 0, mula -mula kehilangan elektron, dan kemudian yang kedua (mengoksidakan), sementara oksigen kekal (ia dikurangkan):
Cu => cu+ + dan-
Cu+ => Cu2+ + dan-
Sama ada2 + 2e- => 22-
Keuntungan atau kehilangan elektron dapat ditentukan dengan mengira nombor pengoksidaan untuk atom dalam formula kimia sebatian yang dihasilkan.
Untuk cu2Atau, diketahui bahawa kerana ia adalah oksida, ia mempunyai anion atau2-, Oleh itu, untuk mengekalkan beban yang dinetralkan setiap dua atom tembaga mesti mempunyai beban +1. Sangat serupa berlaku dengan Cuo.
Tembaga apabila teroksida memperoleh nombor pengoksidaan positif; dan oksigen, dikurangkan, nombor pengoksidaan negatif.
Besi dan kobalt
Contoh tambahan untuk reaksi ditunjukkan di bawah. Begitu juga, komen ringkas akan dibuat dan perubahan dalam nombor pengoksidaan akan ditentukan.
FECL2 + Cocl3 => Fecl3 + Cocl2
Jika nombor pengoksidaan dikira, akan diperhatikan bahawa mereka yang kekal dengan nilai malar -1; Tidak begitu, dengan iman dan co.
Pada pandangan pertama, besi telah teroksida sementara kobalt telah dikurangkan. Bagaimana untuk mengetahui? Kerana besi berinteraksi sekarang tidak dengan dua cl- Tetapi dengan tiga, menjadi atom klorin yang paling elektronegatif daripada besi dan kobalt. Sebaliknya, sebaliknya berlaku kepada kobalt: ia berinteraksi dengan tiga cl- kepada dua dari mereka.
Jika penalaran sebelumnya tidak jelas, persamaan kimia pemindahan bersih elektron ditulis:
Iman2+ => Iman3+ + dan-
Co3+ + dan- => Co2+
Oleh itu iman2+ Ia mengoksidakan, sementara CO3+ dikurangkan.
Iodin dan mangan
6kmno4 + 5KI + 18HCL => 6MNCL2 + 5Kio3 + 6KCL+ 9H2Sama ada
Kimia di atas mungkin kelihatan rumit, tetapi tidak. Klorin (CL-) bukan oksigen (atau2-) Pengalaman keuntungan atau kehilangan elektron mereka. Iodin dan mangan, ya.
Memandangkan hanya sebatian dengan iodin dan mangan yang anda ada:
Ki => kio3 (Nombor pengoksidaan: -1 hingga +5, kehilangan enam elektron)
Kmno4 => Mcl2 (Nombor pengoksidaan: +7 hingga +2, memenangi lima elektron)
Iodin mengoksidakan, sementara mangan dikurangkan. Bagaimana untuk mengetahui tanpa mengira? Kerana iodin pergi dari dengan kalium untuk berinteraksi dengan tiga oksigen (lebih banyak elektronegatif); Sementara itu, mangan itu kehilangan interaksi dengan oksigen untuk bersama dengan klorin (kurang elektronegatif).
Ki tidak dapat kehilangan enam elektron jika kmno4 Menang lima; Itulah sebabnya bilangan elektron mesti seimbang dalam persamaan:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5e- => Mcl2)
Yang menimbulkan pemindahan bersih 30 elektron.
Pembakaran
Pembakaran adalah pengoksidaan yang kuat dan bertenaga di mana cahaya dan haba dilepaskan. Umumnya, dalam jenis oksigen tindak balas kimia ini mengambil bahagian sebagai ejen pengoksidaan atau gabungan; Walaupun ejen pengurangan adalah bahan bakar, yang terbakar pada akhir akaun.
Di mana terdapat abu, ada pembakaran. Ini terdiri daripada arang batu dan oksida logam; Walaupun komposisinya secara logik bergantung pada apa bahan bakarnya. Berikut adalah beberapa contoh:
C (s) + o2(g) => co2(g)
2co (g) + atau2(g) => 2co2(g)
C3H8(g) + 5o2(g) => 3co2(g) + 4h2O (g)
Setiap persamaan ini sesuai dengan pembakaran lengkap; iaitu, semua bahan bakar bertindak balas dengan lebihan oksigen untuk menjamin transformasinya lengkap.
Harus juga diperhatikan bahawa CO2 dan h2Atau mereka adalah produk majoriti gas apabila badan berkarbonat terbakar (seperti kayu, hidrokarbon dan tisu haiwan). Tidak dapat dielakkan bahawa sesetengah alotropik arang batu dibentuk, kerana kekurangan oksigen, serta gas yang kurang oksigen seperti CO dan tidak.
- Sintesis
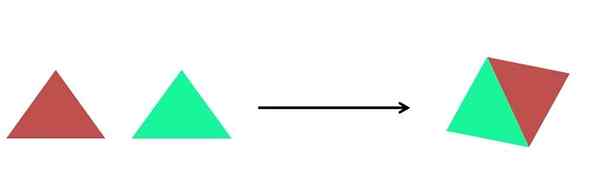
 Perwakilan grafik tindak balas sintesis. Sumber: Gabriel Bolívar.
Perwakilan grafik tindak balas sintesis. Sumber: Gabriel Bolívar. Dalam imej unggul, perwakilan yang sangat mudah ditunjukkan. Setiap segitiga adalah sebatian atau atom, yang bersatu untuk membentuk sebatian tunggal; Dua segitiga membentuk selaras. Jisim meningkat dan sifat fizikal dan kimia produk adalah, selalunya, sangat berbeza dari reagen mereka.
Boleh melayani anda: entalpiSebagai contoh, pembakaran hidrogen (yang juga reaksi Rédox), menghasilkan hidrogen oksida atau hidrida oksigen; lebih dikenali sebagai Agua:
H2(g) + atau2(g) => 2h2O (g)
Dengan mencampurkan kedua -dua gas, pada suhu tinggi, membakar air gas. Suhu yang disejukkan, wap memeluk untuk memberikan air cair. Beberapa penulis menganggap tindak balas sintesis ini sebagai salah satu alternatif yang mungkin untuk menggantikan bahan api fosil dalam mendapatkan tenaga.
H-H dan O = O pautan dipecahkan untuk membentuk dua pautan mudah baru: H-O-H. Air, seperti yang diketahui, adalah bahan yang tiada tandingannya (di luar rasa romantis), dan sifatnya berbeza jauh dari hidrogen dan oksigen gas.
Sebatian ionik
Pembentukan sebatian ionik dari unsur -unsurnya juga merupakan contoh tindak balas sintesis. Salah satu yang paling mudah ialah pembentukan halgenuros logam kumpulan 1 dan 2. Sebagai contoh, sintesis kalsium bromida:
Ca (s) + br2(L) => cabr2(S)
Persamaan umum untuk jenis sintesis ini ialah:
M (s) + x2 => Mx2(S)
Penyelarasan
Apabila sebatian yang terbentuk melibatkan atom logam dalam geometri elektronik, dikatakan bahawa ia adalah kompleks. Di kompleks, logam tetap bersatu dengan ligan oleh ikatan kovalen yang lemah, dan dibentuk oleh reaksi koordinasi.
Sebagai contoh, anda mempunyai kompleks [CR (NH3)6]3+. Ini terbentuk apabila cation3+ berada di hadapan molekul ammonia, NH3, yang bertindak sebagai ligan krom:
Cr3+ + 6nh3 => [CR (NH3)6]3+
Berikut adalah octahedron koordinasi yang dihasilkan di sekitar pusat logam krom:
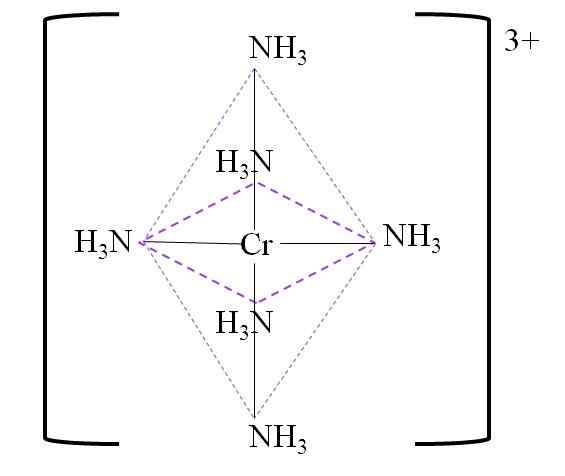 Octahedron koordinasi untuk kompleks. Sumber: Gabriel Bolívar.
Octahedron koordinasi untuk kompleks. Sumber: Gabriel Bolívar. Perhatikan bahawa beban kromium 3+ tidak dinetralkan di kompleks. Warnanya berwarna ungu, dan itulah sebabnya octahedron diwakili dengan warna tersebut.
Sesetengah kompleks lebih menarik, seperti dalam kes enzim tertentu yang menyelaraskan atom besi, zink dan kalsium.
- Penguraian
Penguraian menjadi bertentangan dengan sintesis: sebatian pecah menjadi satu, dua atau tiga elemen atau sebatian.
Sebagai contoh, terdapat tiga penguraian berikut:
2hgo (s) => 2Hg (l) + o2(g)
2h2Sama ada2(L) => 2h2Atau (l) + o2(g)
H2Co3(ac) => co2(g) + h2Atau (l)
HGO adalah pepejal kemerahan yang dengan tindakan haba pecah menjadi merkuri logam, cecair hitam, dan oksigen.
Hidrogen hidrogen peroksida menderita penguraian, memberikan air cair dan oksigen.
Dan asid karbonik, sementara itu, terurai dalam karbon dioksida dan air cair.
Penguraian yang lebih "kering" adalah yang dialami oleh karbonat logam:
Pencuri3(s) => cao (s) + co2(g)
Gunung Berapi Kelas
 Perabot Ammonium Dikromat Gunung Berapi. SUMBER: на mengubah [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Perabot Ammonium Dikromat Gunung Berapi. SUMBER: на mengubah [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Reaksi penguraian yang telah digunakan dalam kelas kimia adalah penguraian terma ammonium dikromat, (NH4)2Cr2Sama ada7. Garam carcanogenal oren ini (jadi ia harus dikendalikan dengan penuh perhatian), terbakar untuk melepaskan banyak haba dan menghasilkan pepejal hijau, oksida kromik, Cr2Sama ada3:
(NH4)2Cr2Sama ada7(s) => cr2Sama ada3(s) + 4H2Atau (g) + n2(g)
- Pemindahan
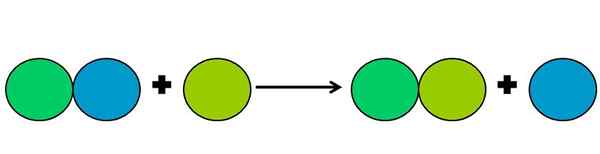 Perwakilan grafik reaksi anjakan. Sumber: Gabriel Bolívar.
Perwakilan grafik reaksi anjakan. Sumber: Gabriel Bolívar. Reaksi anjakan adalah sejenis reaksi rédox di mana satu elemen menggantikan yang lain di sebatian. Elemen yang berpindah akhirnya mengurangkan atau memperoleh elektron.
Untuk memudahkan perkara di atas, imej atas ditunjukkan. Lingkaran mewakili elemen. Adalah diperhatikan bahawa LIMA Green Circle menggantikan Blue One, berada di luar; Tetapi bukan hanya itu, tetapi bulatan biru dikurangkan dalam proses, dan lima hijau dioksidakan.
Daripada hidrogen
Sebagai contoh, persamaan kimia berikut untuk mendedahkan perkara di atas:
2al (s) + 6hcl (ac) => Alcl3(Ac) + 3h2(g)
Zr (s) + 2h2Atau (g) => zro2(s) + 2h2(g)
Zn (s) + h2SW4(ac) => znso4(Ac) + h2(g)
Apakah elemen yang dipindahkan untuk ketiga -tiga tindak balas kimia ini? Hidrogen, yang dikurangkan kepada hidrogen molekul, H2; berlalu dari bilangan pengoksidaan +1 hingga 0. Perhatikan bahawa logam aluminium, zirkonium dan zink boleh menggantikan hidrogen asid dan air; Sementara tembaga, perak atau emas, tidak boleh.
Logam dan halogen
Begitu juga, kedua -dua reaksi anjakan tambahan ini tersedia:
Zn (s) + cuo4(ac) => cu (s) + znso4(Ac)
Cl2(g) + 2nai (ac) => 2nacl (ac) + i2(S)
Dalam reaksi pertama zink menggantikan tembaga logam yang kurang aktif; Zink mengoksidakan semasa tembaga dikurangkan.
Dalam reaksi kedua, sebaliknya, klorin, elemen lebih reaktif daripada yodium, menggantikannya dalam garam natrium. Di sini berlaku ke belakang: unsur yang paling reaktif dikurangkan dengan mengoksidakan elemen yang dipindahkan; Oleh itu, klorin dikurangkan pengoksidaan kepada iodin.
- Pembentukan Gas
Dalam reaksi dapat dilihat bahawa beberapa dari mereka menghasilkan gas, dan oleh itu, mereka juga memasuki jenis reaksi kimia ini. Begitu juga, reaksi bahagian sebelumnya, anjakan hidrogen oleh logam aktif, dianggap sebagai tindak balas pembentukan gas.
Boleh melayani anda: Dodecil natrium sulfat (SDS): Struktur, sifat, kegunaanSebagai tambahan kepada yang telah disebutkan, sulfida logam, sebagai contoh, melepaskan hidrogen sulfida (yang berbau telur busuk) apabila asid hidroklorik ditambah:
Na2S (s) + 2HCl (ac) => 2nacl (ac) + h2S (g)
- Metahesis atau anjakan berganda
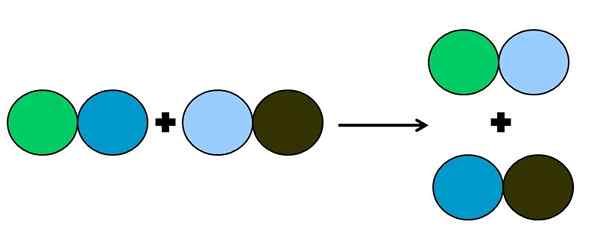 Perwakilan grafik reaksi anjakan berganda. Sumber: Gabriel Bolívar.
Perwakilan grafik reaksi anjakan berganda. Sumber: Gabriel Bolívar. Dalam tindak balas metathesis atau anjakan berganda, apa yang berlaku adalah perubahan pasangan tanpa pemindahan elektron; iaitu, ia tidak dianggap sebagai reaksi rédox. Seperti yang dapat dilihat dalam imej yang unggul, bulatan hijau memecah pautan dengan biru gelap untuk menghubungkan ke bulatan biru muda.
Hujan
Apabila interaksi salah satu pasangan cukup kuat untuk mengatasi kesan solverasi bendalir, endapan diperolehi. Persamaan kimia berikut mewakili tindak balas hujan:
Agno3(ac) + NaCl (ac) => Agcl (s) + nano3(Ac)
CACL2(Ac) + na2Co3(ac) => Caco3(s) + 2nacl (ac)
Dalam reaksi pertama Cl- menggantikan no3- Untuk membentuk klorida perak, agcl, yang merupakan endapan putih. Dan dalam reaksi kedua, CO32- menggantikan Cl- Untuk mendakan kalsium karbonat.
Asid asas
Mungkin reaksi metathanesis yang paling lambang adalah asid asas peneutralan. Akhirnya, dua tindak balas asid asas ditunjukkan sebagai contoh:
HCl (AC) + NaOH (AC) => NaCl (AC) + H2Atau (l)
2HCL (AC) + BA (OH)2(Ac) => bacl2(Ac) + 2h2Atau (l)
Oh- Mereka berpindah ke CL- Untuk membentuk garam air dan klorida.
Contoh tindak balas kimia
Di bawah dan kemudian akan menyebut beberapa tindak balas kimia dengan persamaan dan komen masing -masing.
Pemindahan
Zn (s) + agno3(ac) → 2Ag (s) + Zn (tidak3)2(Ac)
Zink menggantikan perak dalam garam nitratnya: ia mengurangkan ag+ AG. Akibatnya, perak logam mula mendakan di tengah, diperhatikan pada mikroskop yang mana pokok perak. Sebaliknya, nitrat digabungkan dengan ion Zn2+ Hasil membentuk zink nitrat.
Peneutralan
Pencuri3(S) + 2HCL (AC) → CACL2(Ac) + h2Atau (l) + co2(g)
Asid hidroklorik meneutralkan garam kalsium karbonat untuk menghasilkan garam, kalsium klorida, air dan karbon dioksida. Co2 gelembung dan dikesan di dalam air. Bubb ini3.
NH3(g) + HCl (g) → NH4CL (s)
Dalam tindak balas kedua ini, wap HCL meneutralkan ammonia gas. Garam ammonium klorida, NH4CL, terbentuk seperti asap putih (imej yang lebih rendah), kerana ia mengandungi zarah -zarah yang sangat halus yang digantung di udara.
 Reaksi latihan ammonium klorida. Sumber: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Reaksi latihan ammonium klorida. Sumber: Adam Rędzikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Anjakan berganda
Agno3(AC) + NaCl (AC) → AgCl (s) + nano3(Ac)
Dalam reaksi anjakan berganda terdapat pertukaran "pasangan". Perak mengubah pasangan dengan natrium. Hasilnya ialah garam baru, klorida perak, agcl, precipitates seperti pepejal susu.
Rédox
 Dalam reaksi kimia panas menyalak anjing, bunyi dan cahaya biru dilepaskan. Sumber: Maxim Bilovitskiy melalui Wikipedia.
Dalam reaksi kimia panas menyalak anjing, bunyi dan cahaya biru dilepaskan. Sumber: Maxim Bilovitskiy melalui Wikipedia. Ada reaksi yang tidak terhitung rédox. Salah satu yang paling mengagumkan ialah anjing Barkin:
8 n2Atau (g) + 4 cs2(L) → s8(s) + 4 co2(g) + 8 n2(g)
Tenaga yang dikeluarkan adalah begitu banyak apabila tiga produk stabil terbentuk, bahawa kilat kebiruan (imej unggul) dan peningkatan tekanan yang disebabkan oleh gas yang berasal (CO2 dan n2).
Dan selain itu, semua ini disertai dengan bunyi yang sangat kuat yang serupa dengan menggonggong anjing. Sulfur dihasilkan, s8, Tutup kuning dinding dalaman tiub.
Spesies mana yang dikurangkan dan yang dioksidakan? Sebagai peraturan umum, unsur -unsur mempunyai nombor pengoksidaan 0. Oleh itu, sulfur dan nitrogen dalam produk mestilah spesies yang mendapat atau hilang elektron.
Sulfur teroksida (elektron yang hilang), kerana ia mempunyai nombor pengoksidaan -2 dalam CS2 (C4+S22-):
S2- → s0 + 2e-
Walaupun nitrogen dikurangkan (won elektron), kerana ia mempunyai nombor pengoksidaan +1 dalam n2Atau (n2+Sama ada2-):
2n+ + 2e → n0
Latihan reaksi kimia yang diselesaikan
- Latihan 1
Garam apa yang mendahului dalam reaksi seterusnya dalam medium berair?
Na2S (ac) + feso4(Ac) →?
Sebagai peraturan umum, semua sulfida, kecuali dibentuk dengan logam alkali dan ammonium, mendakan dalam medium berair. Anjakan berganda berlaku: Besi mengikat kepada sulfida, dan natrium dengan sulfat:
Na2S (ac) + feso4(ac) → FES (s) + na2SW4(Ac)
- Latihan 2
Produk apa yang akan kita dapat dari reaksi berikut?
Setem3)2 + CA (oh)2 →?
Kalsium hidroksida tidak terlalu larut dalam air; Tetapi penambahan nitrat tembaga membantu solubilitasikannya kerana ia bertindak balas untuk membentuk hidroksida yang sepadan:
Setem3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + ca (tidak3)2(Ac)
Cu (oh)2 Ia diiktiraf dengan serta -merta kerana mendakan biru.
- Latihan 3
Garam apa yang akan berlaku dalam tindak balas peneutralan seterusnya?
Al (oh)3(s) + 3HCl (ac) → ¿¿?
Aluminium hidroksida bertindak sebagai asas yang bertindak balas dengan asid hidroklorik. Dalam tindak balas air peneutralan asid (dari Brnsted-lowry) air sentiasa terbentuk, jadi produk lain mestilah aluminium klorida, ALCL3:
Al (oh)3(s) + 3HCl (ac) → Alll3(Ac) + 3h2Sama ada
Kali ini ALCL3 Ia tidak mendakan kerana ia adalah garam (sedikit sebanyak) larut dalam air.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Ana Zita. (18 November 2019). Tindak balas kimia. Pulih dari: todamateria.com
- Kashyap Vyas. (23 Januari 2018). 19 Reaksi Kimia Sejuk yang Prov Science Falcinating. Pulih dari: menarikininginginging.com
- Cantik Chanchemistry.bersih (s.F.). Tindak balas. Pulih dari: klinik indah.jaring
- Wikipedia. (2019). Tindak balas kimia. Diperoleh dari: dalam.Wikipedia.org

