Sejarah selenium, sifat, struktur, mendapatkan, menggunakan

- 2576
- 710
- Ms. Santos Fritsch
Dia selenium Ia adalah bahan kimia bukan logam yang dimiliki oleh kumpulan 16 jadual berkala dan diwakili oleh simbolnya. Elemen ini mempunyai sifat perantaraan antara sulfur dan telurio, yang merupakan ahli kumpulan yang sama.
Selenium ditemui pada tahun 1817 oleh Jöhs J. Berzelius dan John G. Gahn, yang menguap pirit memerhatikan sisa merah (imej yang lebih rendah). Pada mulanya mereka membingungkannya dengan telurio, tetapi kemudian menyedari bahawa mereka menghadapi elemen baru.
 Sebotol dengan selenium merah amorf, alotropik yang paling terkenal untuk elemen ini. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Sebotol dengan selenium merah amorf, alotropik yang paling terkenal untuk elemen ini. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Berzelius memanggil Elemen Baru sebagai Selenium, berdasarkan nama "Selene" yang bermaksud "Dewi Bulan". Selenium adalah jejak penting untuk tumbuh -tumbuhan dan haiwan, walaupun dalam kepekatan tinggi ia adalah elemen toksik.
Selenium mempunyai tiga bentuk allotropik utama: merah, hitam dan kelabu. Yang terakhir ini mempunyai milik mengubah suai konduktansi elektriknya berdasarkan keamatan cahaya yang memancarkannya (photoconductor), jadi ia mempunyai banyak aplikasi.
Selenium diedarkan secara meluas di kerak bumi, namun mineral yang mengandunginya tidak banyak, jadi tidak ada eksploitasi perlombongan selenium.
Ia diperolehi sebagai produk sekunder proses penapisan oleh elektrolisis tembaga. Selenium berkumpul di lendir yang berada di anod sel elektrolisis.
Manusia mempunyai sekitar 25 seleenoprotein, yang sebahagiannya memenuhi tindakan antioksidan dan mengawal penjanaan radikal bebas. Terdapat juga asid amino selenium, seperti selenomectionine dan selenocysteine.
[TOC]
Sejarah
Pemerhatian pertama
Alchemist Arnold of Villanova mungkin telah mengamati selenium pada tahun 1230. Ini terbentuk dalam bidang perubatan di Sorbonne Paris, dan bahkan Doktor Paus Clemente V.
Villanova dalam bukunya Rosarium Philosophorum Terangkan sulfur merah atau "sulfur reboule" yang masih dalam ketuhar selepas menguap belerang. Sulfur merah ini boleh menjadi alotropik selenium.
Penemuan
Pada tahun 1817, Jöhs Jakob Berzelius dan John Gottlieb Gahn menemui selenium dalam loji kimia untuk pengeluaran asid sulfurik, berhampiran Gripsholm, Sweden. Bahan mentah untuk penjelasan asid adalah pirit, yang diekstrak dari lombong falun.
Berzelius diserang oleh kewujudan sisa merah yang kekal di dalam bekas utama selepas sulfur telah dibakar.
Juga, Berzelius dan Gahn mengamati bahawa sisa merah mempunyai bau lobak pedas yang kuat, sama seperti yang dibentangkan oleh telurio. Sebab mengapa, dia menulis kepada rakannya Marect bahawa mereka percaya bahawa deposit yang diperhatikan adalah sebatian telurio.
Walau bagaimanapun, Blelius terus menganalisis bahan yang didepositkan dengan membakar pirit dan menimbang semula bahawa telurio belum dijumpai di falun. Disimpulkan pada bulan Februari 1818 bahawa dia telah menemui elemen baru.
Asal Nama Anda
Berzelius menunjukkan bahawa elemen baru adalah gabungan sulfur dan telurio, dan persamaan telurio dengan elemen baru telah memberinya peluang untuk menamakan bahan selenium baru.
Berzelius menjelaskan bahawa "Tellus" bermaksud dewi bumi. Martin Klaport pada tahun 1799 meletakkan nama ini ke Telurio dan menulis: "Tidak ada elemen yang dipanggil dengan cara itu. Ia mesti dilakukan!".
Oleh kerana persamaan telurio dengan bahan baru, Berzelius memanggilnya dengan kata selenium, yang berasal dari perkataan Yunani "selene" yang bermaksud "dewi bulan".
Pembangunan aplikasi anda
Pada tahun 1873 Willoughby Smith mendapati bahawa kekonduksian elektrik yang dibentangkan oleh selenium bergantung kepada cahaya yang memancarkannya. Harta ini membolehkan selenium mempunyai banyak aplikasi.
Alexander Graham Bell pada tahun 1979 menggunakan selenium di fotophone beliau. Selenium menghasilkan arus elektrik berkadar dengan intensiti cahaya yang menerangi, menggunakan meter cahaya, mekanisme keselamatan untuk pembukaan dan penutup pintu, dll.
Penggunaan penerus selenium dalam elektronik bermula dari tahun 1930 -an, dengan banyak aplikasi komersial. Pada tahun 1970 -an, dia digantikan dalam penerus untuk silikon.
Pada tahun 1957 didapati bahawa selenium adalah elemen penting untuk kehidupan mamalia, kerana ia hadir dalam enzim yang melindungi dari oksigen reaktif dan radikal bebas. Di samping itu, kewujudan asid amino seperti selenometionine ditemui.
Sifat fizikal dan kimia
Penampilan
Terdapat beberapa alotrop untuk selenium, penampilan fizikal mereka berbeza -beza. Ia biasanya dibentangkan sebagai pepejal kemerahan dalam bentuk habuk.
Berat atom standard
78,971 u
Nombor atom (z)
3. 4
Takat lebur
221 ºC
Takat didih
685 ºC
Ketumpatan
Ketumpatan selenium berbeza -beza bergantung kepada yang alotropik atau polimorf dianggap. Beberapa kepadatan yang ditentukan pada suhu bilik adalah:
Kelabu: 4,819 g/cm3
ALFA: 4.39 g/cm3
Vitreous: 4.28 g/cm3
Keadaan cecair (titik lebur): 3.99 g/cm3
Haba Fusion
Kelabu: 6.69 kJ/mol
Haba pengewapan
95.48 kJ/mol
Kapasiti kalori molar
25,363 j/(mol · k)
Nombor pengoksidaan
Selenium boleh dikaitkan dengan sebatiannya yang menunjukkan nombor berikut atau pengoksidaan berikut: -2, -1, +1, +2, +3, +4, +5, +6. Antaranya, yang paling penting ialah -2 (2-), +4 (saya tahu4+) dan +6 (saya tahu6+).
Boleh melayani anda: mikroskop sederhanaContohnya, dalam SEO2 Selenium mempunyai nombor pengoksidaan +4; iaitu, kewujudan kation diandaikan4+ (Dia4+Sama ada22-). Sama dengan SEO3 Selenium mempunyai nombor pengoksidaan +6 (i6+Sama ada32-).
Dalam hidrogen seleniuro, h2SE, selenium mempunyai bilangan pengoksidaan -2; iaitu, sekali lagi, kewujudan ion atau anion diandaikan2- (H2+Dia2-). Ini kerana selenium lebih elektronegatif daripada hidrogen.
Elektronegativiti
2.55 pada skala Pauling.
Tenaga pengionan
-Pertama: 941 kJ/mol.
-Kedua: 2.045 kJ/mol.
-Ketiga: 2.973.7 kJ/mol.
Urutan magnet
Diamagnetic.
Kekerasan
2.0 pada skala Mohs.
Isotop
Terdapat lima isotop semulajadi dan stabil selenium, yang ditunjukkan di bawah dengan kelimpahan masing -masing:
-74SE (0.86%)
-76SE (9.23%)
-77SE (7.6%)
-78SE (23.69%)
-80SE (49.8%)
Allotropy
 Botol hitam yang dilapisi dengan filem nipis selenium kelabu. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Botol hitam yang dilapisi dengan filem nipis selenium kelabu. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Selenium yang disediakan dalam tindak balas kimia adalah bata serbuk amorf merah bata, yang apabila bentuk hitam vitreous diasaskan, sama dengan akaun Rosario (imej unggul). Selenium hitam adalah pepejal yang rapuh dan berkilau.
Di samping itu, selenium hitam sedikit larut dalam karbon sulfida. Apabila penyelesaian ini dipanaskan pada 180 ºC, selenium kelabu mendahului, alotropik yang paling stabil dan padat.
Selenium kelabu tahan terhadap pengoksidaan dan tidak aktif dengan tindakan asid bukan pengoksidaan. Harta utama selenium ini adalah photoconductivitynya. Diterangi meningkatkan kekonduksian elektriknya dengan faktor 10 hingga 15 kali.
Reaktiviti
Selenium dalam sebatiannya wujud dalam keadaan pengoksidaan -2, +4 dan +6. Menunjukkan kecenderungan yang jelas untuk membentuk asid dalam keadaan pengoksidaan yang lebih tinggi. Sebatian yang mempunyai selenium dengan keadaan pengoksidaan -2, dipanggil seleniuros (2-).
Tindak balas hidrogen
Selenium bertindak balas dengan hidrogen untuk membentuk seleniuro hidrogen (h2SE), gas yang tidak berwarna, mudah terbakar dan berbau.
Reaksi oksigen
Selenium terbakar dengan memancarkan api biru dan membentuk selenium dioksida:
Dia8 (s) + 8 o2 => 8 seo2 (S)
Selenium oksida adalah bahan polimer, putih dan pepejal. Penghidratannya menghasilkan asid selenous (h2Seo3). Selenium juga membentuk selenium trioksida (SEO3), Sama dengan sulfur (begitu3).
Tindak balas dengan halogen
Selenium bertindak balas dengan fluorida untuk membentuk selenium hexafluoruro:
Dia8 (s) +24 f2 (g) => 8 SEF6 (L)
Selenium bertindak balas dengan klorin dan bromin untuk membentuk diklorida dan dysilenium dibromure, masing -masing:
Dia8 (s) +4 cl2 => 4 se2Cl2
Dia8 (s) +4 br2 => 4 se2Br2
Selenium juga boleh membentuk SEF4 dan secl4.
Sebaliknya, selenium membentuk sebatian di mana atom selenium menyertai salah satu halogen dan satu lagi oksigen. Contoh penting ialah selenium oxychloride (SEO2Cl2), Dengan selenium dalam pengoksidaan +6, pelarut yang sangat kuat.
Tindak balas dengan logam
Selenium bertindak balas dengan logam untuk membentuk aluminium, kadmium dan natrium seleniuros. Kimia di bawah sepadan dengan pembentukan aluminium seleniuro:
3 se8 + 16 al => 8 hingga2Dia3
Selenitas
Selenium membentuk garam yang dikenali sebagai selenitas; Contohnya: Silver Selenite (AG2Seo3) dan natrium selenit (na2Seo3). Nama ini telah digunakan, dalam konteks sastera, merujuk kepada penduduk bulan: selenitas.
Asid
Asid selenium yang paling penting ialah asid Sealnic (h2Seo4). Ia sama kuat dengan asid sulfurik dan lebih mudah dikurangkan.
Struktur dan konfigurasi elektronik
- Selenium dan pautannya
Selenium mempunyai enam elektron Valencia, itulah sebabnya ia terletak di Kumpulan 16, sama seperti oksigen dan sulfur. Enam elektron ini terdapat dalam orbital 4s dan 4p, mengikut konfigurasi elektronik mereka:
[AR] 3D10 4s2 4p4
Oleh itu, seperti sulfur, membentuk dua ikatan kovalen untuk melengkapkan oktet Valencia; Walaupun ia mempunyai ketersediaan orbital 4D untuk menghubungkan lebih dari dua atom. Oleh itu, tiga atom selenium mendekati dan membentuk dua ikatan kovalen: se-se-se.
Selenium dengan jisim atom yang lebih besar mempunyai kecenderungan semula jadi untuk membentuk struktur yang ditadbir oleh ikatan kovalen; bukannya diatur sebagai molekul diatom2, Se = se, sama dengan o2, O = O.
- Cincin atau rantai
Antara struktur molekul yang diterima pakai oleh atom selenium, dua boleh disebutkan secara umum: cincin atau rantai. Perhatikan bahawa dalam kes hipotetikal SE3, Atom masih diperlukan oleh hujungnya; Oleh itu, mereka mesti menghubungkan ke atom lain, berturut -turut, sehingga rantai dapat ditutup dalam cincin.
Cincin yang paling biasa adalah lapan ahli atau atom selenium:8 (Mahkota selenit). Mengapa lapan? Kerana cincin yang lebih kecil, semakin besar ketegangan akan menderita; Iaitu, sudut pautan mereka menyimpang dari nilai semula jadi yang ditetapkan oleh hibridisasi SP mereka3 (Sama seperti dengan sikloalcanos).
Boleh melayani anda: suntikan pascalTerdapat lapan atom, pemisahan antara atom SEM cukup untuk pautan mereka menjadi "santai" dan tidak "dilipat"; Walaupun sudut pautannya adalah 105.7 dan bukan 109.5. Sebaliknya, mungkin terdapat cincin yang lebih kecil: i6 dan7.
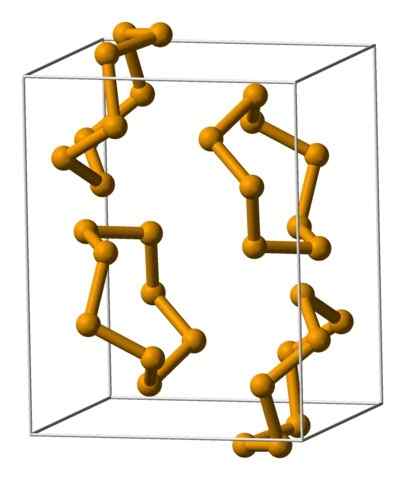 Unit Analeres Selenium diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 [domain awam].
Unit Analeres Selenium diwakili dengan model sfera dan bar. Sumber: Benjah-bmm27 [domain awam]. Di bahagian atas, unit analeres ditunjukkan8. Perhatikan persamaan yang mereka ada dengan mahkota belerang; Hanya mereka yang lebih besar dan berat.
Sebagai tambahan kepada cincin, atom selenium juga boleh diatur dalam rantai heliks (berfikir pada tangga siput):
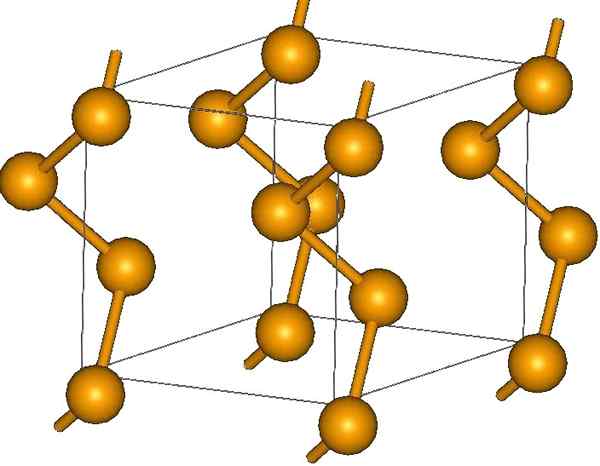 Rantai selenium heliks. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Rantai selenium heliks. Sumber: MaterialScientist di Bahasa Inggeris Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Di hujungnya mungkin terdapat pautan terminal berganda (-se = se), atau cincin adalah8.
- Alotropes
Mengambil kira bahawa mungkin terdapat cincin helical selenium atau rantai, dan dimensi mereka juga boleh berbeza -beza bergantung kepada bilangan atom yang mereka ada, maka jelas bahawa terdapat lebih dari satu alotropik untuk elemen ini; Ini adalah pepejal selenium murni tetapi dengan struktur molekul yang berbeza.
Selenium merah
Antara alotropes selenium yang paling menonjol kita mempunyai merah, yang boleh dibentangkan sebagai debu amorf, atau sebagai kristal monoklinik dan polimorfik (lihat imej cincin adalah8).
Dalam selenium merah amorf, struktur tidak senonoh, tanpa corak yang jelas; Semasa dalam lensa, cincin menubuhkan struktur monoklinik. Selenium merah kristal adalah polimorfik, mempunyai tiga fasa: α, β dan γ, yang berbeza dalam kepadatan mereka.
Selenium hitam
Struktur selenium hitam juga terdiri daripada cincin; Tetapi tidak lapan ahli, tetapi banyak lagi, terdapat cincin seribu atom (1000). Ia kemudian dikatakan bahawa strukturnya adalah rumit dan terdiri daripada cincin polimer; sebilangan besar atau kecil daripada yang lain.
Apabila terdapat cincin polimer dengan saiz yang berbeza, sukar untuk menunggu perintah struktur untuk ditubuhkan; Jadi selenium hitam juga amorf, tetapi berbeza dengan debu kemerahan yang disebutkan di atas, ia mempunyai konteks yang berkaca, walaupun ia rapuh.
Selenium kelabu
Dan akhirnya, dari alotrope yang paling mudah dari selenium adalah kelabu, yang menonjol di atas yang lain dengan menjadi yang paling stabil di bawah keadaan normal, dan juga mempunyai penampilan logam.
Kristal mereka boleh menjadi heksagon atau trigonal, yang ditubuhkan oleh daya penyebaran London antara rantai heliks polimer mereka (imej unggul). Sudut pautannya adalah 130.1 º, yang menunjukkan sisihan positif persekitaran tetrahedral (dengan sudut 109.5 °).
Itulah sebabnya rantai helical selenium memberi kesan menjadi "terbuka". Dengan cara elucubration, dalam struktur ini atom -atom dihadapkan, jadi secara teori mesti ada pertindihan yang lebih besar dari orbital mereka untuk membuat band memandu.
Haba dengan peningkatan getaran molekul membahayakan band -band ini apabila rantai tidak senonoh; Walaupun tenaga foton secara langsung mempengaruhi elektron, menarik mereka dan mempromosikan urus niaga mereka. Dari visi ini, "mudah" untuk membayangkan photoconductivity untuk selenium kelabu.
Di mana dan pengeluaran
Walaupun ia diedarkan secara meluas, selenium adalah elemen yang jarang berlaku. Ia berada di negeri asal yang dikaitkan dengan sulfur dan mineral seperti eucairita (cuagse), cloustalita (pbse), naumanite (ag Ag2Se), dan Crookesite [(Cutiag)2Dia].
Selenium didapati sebagai kekotoran yang menggantikan sulfur dalam sebahagian kecil mineral sulfur logam; seperti tembaga, plumbum, perak, dll.
Terdapat tanah di mana selenium wujud dalam bentuk selenate larut. Ini dibawa oleh perairan hujan ke sungai dan dari sana, ke arah lautan.
Beberapa tumbuhan dapat menyerap dan menumpukan selenium. Contohnya, secawan kacang di Brazil mengandungi 544 μg selenium, jumlah yang bersamaan dengan 777% daripada jumlah selenium yang disyorkan setiap hari.
Dalam makhluk hidup, selenium ditemui dalam beberapa asid amino, seperti: selenometionine, selenocysteine dan methylselenocysteine. Selenocysteine dan selenit dikurangkan kepada seleniuro hidrogen.
Elektrolisis tembaga
Tidak ada eksploitasi selenium perlombongan. Sebahagian besar diperolehi sebagai produk sekunder proses penapisan oleh elektrolisis tembaga, berada di lumpur yang terkumpul di anod.
Langkah pertama terdiri daripada pengeluaran selenium dioksida. Untuk ini, tipis anodik dengan natrium karbonat dirawat untuk menghasilkan pengoksidaannya. Kemudian selenium oksida ditambah air dan diasaskan untuk membentuk asid selenik.
Akhirnya, ia adalah asid selenous dengan sulfur dioksida untuk menghasilkan pengurangannya dan mendapatkan selenium asas.
Dalam kaedah lain dalam campuran lumpur dan lumpur yang terbentuk dalam pengeluaran asid sulfurik, selenium merah yang suci diperolehi yang larut dalam asid sulfurik.
Asid selener dan asid sellenik kemudian terbentuk. Asid selenious ini menerima rawatan yang sama dengan kaedah sebelumnya.
Klorin juga boleh digunakan, yang bertindak pada seleniuros logam untuk menghasilkan sebatian selenium berklorin yang tidak menentu; seperti: saya tahu2Cl2, SECL4, SECL2 dan seocl2.
Boleh melayani anda: tahap kimiaSebatian ini, dalam proses yang dijalankan di dalam air, menjadi asid selenous, yang dirawat dengan sulfur dioksida untuk melepaskan selenium.
Kertas Biologi
Kekurangan
Selenium adalah jejak penting bagi tumbuh -tumbuhan dan haiwan, yang kekurangannya pada manusia telah menyebabkan gangguan serius seperti penyakit Keshan; Penyakit yang dicirikan oleh kerosakan miokardium.
Di samping itu, kekurangan selenium dikaitkan dengan ketidaksuburan lelaki dan boleh memainkan peranan dalam penyakit Kashin-Beck, sejenis osteoarthritis. Begitu juga, kekurangan selenium telah diperhatikan dalam arthritis rheumatoid.
Cofactor enzimatik
Selenium adalah komponen enzim dengan tindakan antioksidan, seperti glutationa peroxidase dan tioresodoxin reductase yang bertindak dalam penghapusan bahan dengan oksigen reaktif.
Di samping itu, selenium adalah cofactor hormon tiroid desiodinases. Enzim -enzim ini penting dalam mengawal fungsi hormon tiroid.
Penggunaan selenium telah ditunjukkan dalam rawatan penyakit Hasimoto, penyakit autoimun dengan pembentukan antibodi terhadap sel tiroid.
Selenium juga telah digunakan untuk mengurangkan kesan toksik merkuri, kerana beberapa tindakannya dikenakan pada enzim antioksidan yang bergantung kepada selenium.
Protein dan asid amino
Lelaki itu mempunyai kira -kira 25 seleenoprotein yang melakukan tindakan antioksidan untuk perlindungan terhadap tekanan oksidatif, yang dimulakan oleh lebihan spesies oksigen reaktif (ROS) dan spesies nitrogen reaktif (NI).
Kehadiran asid amino selenomethytheocin dan selenocysteine pada manusia telah dikesan. Selenomectionine digunakan sebagai makanan tambahan dalam rawatan keadaan kekurangan selenium.
Risiko
Kepekatan badan selenium yang tinggi boleh memberi kesan berbahaya kepada kesihatan, bermula dengan rambut rapuh dan kuku rapuh, hingga ruam kulit, haba, edema kulit dan kesakitan yang teruk.
Semasa berurusan dengan selenium bersentuhan dengan mata, orang dapat menyatakan semangat, kerengsaan dan air mata. Sementara itu, pendedahan yang berpanjangan kepada asap dengan kandungan selenium yang tinggi, boleh menyebabkan edema pulmonari, nafas bawang putih dan bronkitis.
Di samping itu, orang itu mungkin mengalami pneumonitis, mual, menggigil, demam, sakit tekak, cirit -birit dan hepatomegaly.
Selenium boleh berinteraksi dengan ubat lain dan makanan tambahan, seperti antacid, ubat antineoplastik, kortikosteroid, niacin dan pil untuk kawalan kelahiran.
Selenium dikaitkan dengan peningkatan risiko kontrak kanser kulit. Dalam satu kajian oleh Institut Kanser Kebangsaan, ditunjukkan bahawa lelaki dengan kepekatan badan selenium yang tinggi mempunyai dua kali sebagai kebarangkalian penderitaan kanser prostat yang agresif.
Kajian menunjukkan bahawa pengambilan harian 200 μg selenium, meningkat sebanyak 50% kemungkinan membangunkan diabetes jenis II.
Aplikasi
Kosmetik
Selenium sulfida digunakan dalam rawatan seborrhea, serta lemak atau kelemumur.
Doktor
Ia digunakan sebagai ubat alternatif dalam rawatan penyakit hasimoto, penyakit tiroid autoimun.
Selenium mengurangkan ketoksikan merkuri, yang salah satu aktiviti toksiknya dikenakan ke atas enzim deoksida, yang menggunakan selenium sebagai cofactor.
Elektrolisis mangan
Penggunaan selenium oksida dalam elektrolisis mangan dengan ketara mengurangkan kos teknik, kerana penggunaan elektrik berkurangan.
Pigmen
Selenium digunakan sebagai pigmen dalam lukisan, plastik, seramik dan kaca. Bergantung pada selenium yang menggunakan warna kaca berbeza dari merah ke dalam oren cahaya.
Photoconductive
Oleh kerana sifat selenium kelabu mengubah kekonduksian elektriknya bergantung kepada intensiti cahaya yang memancarkannya, selenium telah digunakan dalam fotokopi, fotokopi, fotometer dan sel solar.
Penggunaan selenium dalam fotokopi adalah salah satu aplikasi selenium utama; Tetapi penampilan fotokonduktor organik telah mengurangkan penggunaannya.
Kristal
Selenium digunakan untuk perubahan warna kaca, akibat kehadiran besi yang menghasilkan pewarnaan hijau atau kuning. Di samping itu, ia membolehkan pewarnaan merah kaca, bergantung pada penggunaan yang anda ingin berikan.
VULCANIZATION
Dietenio Dietenium digunakan sebagai agen vulcanizing produk getah.
Aloi
Selenium digunakan dalam kombinasi dengan bismut di tembaga, untuk menggantikan plumbum; Elemen yang sangat toksik yang telah menurunkan penggunaannya kerana cadangan agensi kesihatan.
Selenium ditambah kepada kepekatan rendah ke aloi keluli dan tembaga untuk meningkatkan kemudahan penggunaan logam ini.
Penerus
Pengarah Selenium mula digunakan pada tahun 1933 hingga tahun 1970 -an, ketika mereka digantikan oleh silikon dengan kos rendah dan kualiti yang lebih tinggi.
Rujukan
- Institut Kimia Royal Australia. (2011). Selenium. [Pdf]. Pulih dari: Raci.org.Au
- Wikipedia. (2019). Selenium. Diperoleh dari: dalam.Wikipedia.org
- Sato Kentaro. (s.F.). Allotropes baru elemen kumpulan utama. [Pdf]. Diperolehi dari: Tcichemicals.com
- Dr. Dough Stewart. (2019). Fakta elemen selenium. Chemicool. Pulih dari: chemicool.com
- Robert c. Brazted. (28 Ogos 2019). Selenium. Encyclopædia Britannica. Pulih dari: Britannica.com
- Marques Miguel. (s.F.). Selenium. Pulih dari: nautilus.Fis.UC.Pt
- Helmestine, Anne Marie, Ph.D. (3 Julai 2019). Fakta selenium. Pulih dari: Thoughtco.com
- Lentech b. V. (2019). Jadual Tempoh: Selenium. Pulih dari: lentech.com
- Tinggi u. (2008). Selenium: Peranannya sebagai antioksidan dalam kesihatan manusia. Kesihatan alam sekitar dan mencegah ubat, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Pejabat Suplemen Diet. (9 Julai 2019). Selenium: Lembaran Fakta untuk Profesional Kesihatan. Institut Kesihatan Kebangsaan. Diperolehi dari: SDG.OD.NIH.Gov

