Penyelesaian penyerap kejutan

- 5058
- 346
- Mr. Tracy Parisian
Kami menerangkan apakah penyelesaian redaman, sifat, komponen, jenis, dan memberi beberapa contoh
 Penyelesaian penyerap kejutan mengawal pH sekitar nilai tertentu
Penyelesaian penyerap kejutan mengawal pH sekitar nilai tertentu Apakah penyelesaian redaman?
The Penyelesaian penyerap kejutan, Juga dipanggil buffer, pH atau pengawal selia buffer, penyelesaian berair yang dibentuk oleh asid lemah dan asas konjugasi atau asas yang lemah dan asid konjugasi.
Mereka dipanggil penyelesaian penyerap kejutan, kerana mereka mempunyai keupayaan untuk mengatasi perubahan pH selepas penambahan asid atau pangkalan dalam kuantiti yang kecil, walaupun ia adalah asid atau pangkalan yang kuat.
Penyelesaian penyerap kejutan sangat berguna, kerana ia membenarkan pH menjadi tetap. Terdapat banyak tindak balas kimia yang memerlukan pH tertentu dan tetap berfungsi dengan baik.
Sifat penyelesaian morpainary
Mereka adalah penyelesaian berair
Kedua -dua konsep pH dan skala pH hanya masuk akal dalam penyelesaian berair, jadi semua buffer atau penyelesaian redaman disediakan di dalam air.
Operasinya didasarkan pada keseimbangan asid-asas dan prinsip-prinsip Le Chatlier
Buffer didasarkan pada reaksi pemisahan asid/asas yang boleh diterbalikkan yang berada dalam keseimbangan. Dengan menambahkan asid atau asas yang kuat ke alam sekitar, keseimbangan ini terganggu, jadi sistem bertindak balas untuk mengatasi gangguan, berikutan prinsip -prinsip Le Catelier. Ini adalah bagaimana penampan berjaya mengatasi perubahan besar dalam pH.
PH anda mudah dikira dengan persamaan Henderson-Haselbalch
Tidak kira apa jenis penyelesaian penyerap kejutan, pH sebelum dan selepas menambah sedikit asid atau pangkalan yang kuat, ia boleh dikira dengan persamaan Henderson-Hohaselbalch:
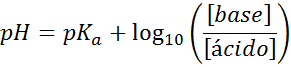
Di mana [asas] merujuk kepada kepekatan molar asas (atau garam asas konjugasi) dan [asid] merujuk kepada kepekatan molar asid (atau garam asid konjugasi).
Boleh melayani anda: Bahan elastikMereka dapat meneutralkan sebahagian asid dan pangkalan sebahagiannya
Penyelesaian redaman terdiri daripada bahan asas dan bahan asid, yang dapat meneutralkan pangkalan dan asid, masing -masing. Atas sebab ini, mereka boleh mengatasi pH selepas penambahan kedua -dua asid kuat dan pangkalan yang kuat.
Operasinya bergantung pada suhu
PH penyelesaian penampan bergantung kepada keasidan atau pemalar asas asid atau asas yang lemah yang mengandungi. Pemalar ini bergantung pada suhu, jadi operasi penyelesaian ini juga bergantung pada suhu.
Semakin tertumpu, semakin besar keupayaannya untuk mengatasi atau mengawal pH
Kapasiti redaman bergantung kepada jumlah kepekatan penyelesaian adalah lebih besar daripada kepekatan akhir asid atau asas yang kuat yang ditambah. Atas sebab ini, semakin besar jumlah kepekatan penyelesaian penampan, semakin besar keupayaannya untuk asid kusyen atau pangkalan yang kuat.
Komponen penyelesaian redaman atau penampan
Secara kimia, penyelesaian redaman dibentuk oleh hanya dua komponen. Komponen ini boleh menjadi asid lemah dicampur dengan garam dari pangkalan konjugasi atau asas lemah dicampur dengan garam asid konjugasi.
Terdapat dua cara yang berbeza untuk mendapatkan komponen ini dalam penyelesaian yang sama, seperti yang akan kita lihat di bawah:
1. Penyediaan buffer mencampurkan penyelesaian komponennya
Ini adalah cara paling langsung untuk menyediakan penyelesaian penampan. Untuk melakukan ini, penyelesaian berasingan asid lemah (contohnya, asid asetik) dan garam asas konjugasi (contohnya, natrium asetat) disediakan penyelesaian berasingan). Maka kedua -dua penyelesaian secara beransur -ansur mencampurkan sehingga pH yang dikehendaki.
Ia boleh melayani anda: ion ammonium (NH4+): Formula, sifat dan kegunaan
- Penyelesaian dicampur sedikit demi sedikit sehingga pH yang dikehendaki
2. Penyediaan buffer dengan meneutralkan separa penyelesaian asid lemah
Dalam kes ini, larutan asid yang lemah disediakan dengan kepekatan total yang dikehendaki, dan kemudian natrium atau kalium hidroksida ditambah sedikit demi sedikit sehingga mencapai pH yang dikehendaki.
Jenis Penyelesaian Buffer
Penyelesaian penyerap kejutan dapat diklasifikasikan mengikut jenis komponen yang mereka miliki atau menurut pH terakhir mereka.
Menurut jenis komponen:
- Penampan asas yang lemah dan konjugasi: Dalam kes ini pH bergantung pada pkke asid lemah.
- Penampan asas lemah dan asid konjugasi: Dalam kes ini, pH bergantung pada pkb lemah.
- Penampan garam asid poliprotik: Dalam sesetengah kes kedua -dua peranan asid lemah dan asas konjugasi adalah kedua -dua garam dari peneutralan separa asid yang mempunyai beberapa proton seperti asid sulfurik atau fosforik.
Menurut pH terakhirnya:
Bergantung pada keasidan atau pemalar asas, penyelesaian penampan dapat mengawal pH di sekitar julat pH yang berlainan, yang menimbulkan tiga jenis buffer:
- Buffer Asid: Adakah mereka yang mengawal pH sekitar nilai lebih rendah daripada 7. Mereka bersedia dengan asid lemah yang PKke kurang dari 7 atau dengan pangkalan yang lemah yang pkb lebih besar daripada 7.
- Buffer neutral: Adakah mereka yang mengawal pH sekitar 7. Mereka biasanya terdiri daripada asid atau pangkalan yang lemah yang mempunyai PKke atau pkb hampir 7.
- Buffer alkali: Adakah mereka yang mengawal pH sekitar nilai lebih besar daripada 7. Mereka bersedia dengan asid lemah yang PKke lebih besar daripada 7 atau dengan pangkalan yang lemah yang pkb kurang dari 7.
Contoh buffer atau penyelesaian redaman
Penampan asid asetik/natrium asetat
Ini adalah penampan asid lemah (asid asetik) dan garam asas konjugasi (natrium asetat). Keseimbangan yang terlibat dan pemalar keseimbangannya adalah:
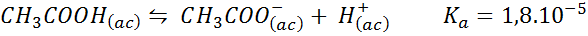
Penampan ini mengawal pH sekitar 4.74.
Buffer Ammonia/Ammonium Chloride
Ini adalah penampan asas yang lemah (ammonia atau ammonium hidroksida) dan garam asid konjugasi (ammonium klorida). Keseimbangan yang terlibat dan pemalar keseimbangannya adalah:
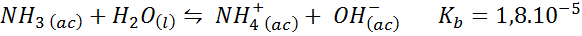
Ini adalah penampan alkali yang mengawal pH sekitar 9.26.
Penampan bisulfat/sulfat
Dalam kes ini, ion bisulfat memainkan kertas asid lemah yang asas konjugatnya adalah ion sulfat. Keseimbangan yang terlibat adalah:
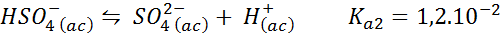
Ini adalah penyelesaian asid yang mengawasi pH 3.05.
Asid karbonik/penampan bikarbonat
Ini adalah salah satu sistem peraturan pH yang paling penting dalam darah kita. Reaksi yang terlibat adalah: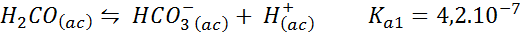
Penampan ini mengawal pH sekitar 6.38.
Dihydrogen buffer fosfat/hidrogen fosfat
Ini adalah salah satu sistem peraturan pH yang paling banyak digunakan dalam biologi dan biokimia, kerana ia membolehkan mengawal pH sangat dekat dengan pH fisiologi yang mana kebanyakan reaksi kimia dalam sel berlaku. Tindak balasnya adalah:
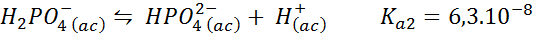
Penampan ini mengawal pH sekitar 7.20.

