Ammonium sulfat
- 3829
- 169
- Ismael Turner
Kami menerangkan apakah ammonium sulfat, struktur kimia, sifat fizikal dan kimia, dan kegunaan
Apa itu ammonium sulfat?
Dia Ammonium sulfat Ia adalah garam tak organik ternary dan ammonia asid sulfurik. Formula kimianya adalah (NH4)2SW4. Oleh itu, perkadaran stoikiometri mengatakan bahawa untuk setiap anion sulfat terdapat dua kation ammonium berinteraksi dengannya. Ini membolehkan neutral garam ((+1) ∙ 2 + (-2)).
Talian tatanannya disebabkan oleh fakta garam yang diperoleh dari h2SW4, Menukar akhiran "uric" untuk "ato". Oleh itu, kedua -dua proton awal digantikan oleh NH4+, produk tindak balas dengan ammonia (NH3). Jadi, persamaan kimia untuk sintesisnya ialah: 2 nh3 + H2SW4 => (NH4)2SW4
Ammonium sulfat juga disediakan oleh tindak balas ammonium karbonat dengan kalsium sulfat: (NH4)2Co3 + Kes4 => (NH4)2SW4 + Pencuri3, Menentukan karbonat calico, yang dipisahkan dari baki cecair.
Ammonium sulfat adalah penyimpanan nitrogen dan sulfur, kedua -duanya tidak diperlukan dalam kimia tanah dan baja.
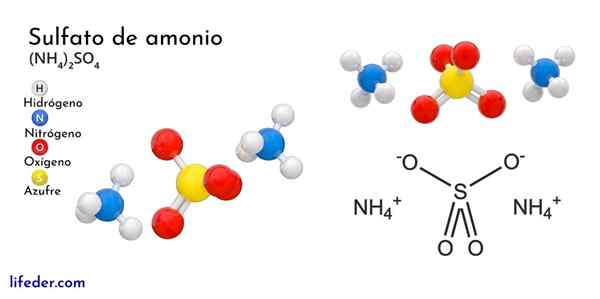
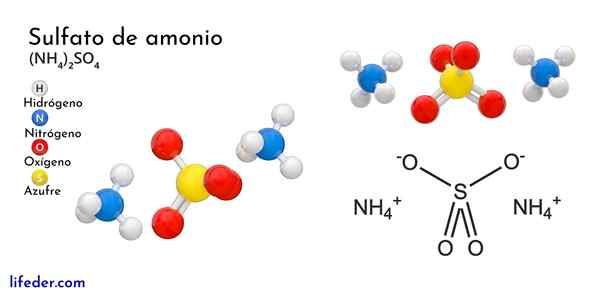
Struktur kimia ammonium sulfat

Imej unggul menggambarkan geometri molekul ion NH4+ Dan juga42-. Sfera merah sesuai dengan atom oksigen, putih ke atom hidrogen, biru ke atom nitrogen dan kuning ke atom sulfur.
Kedua -dua ion boleh dianggap sebagai dua tetrahedra, sehingga mempunyai tiga unit yang berinteraksi untuk membentuk susunan kristal ortorrombik. Anion sulfat begitu42- Dan ia dapat menderma atau menerima empat jambatan hidrogen, serta kation NH4+.
Sifat ammonium sulfat
Berat molekul
132,134 g/mol.
Ia dapat melayani anda: hubungan kimia dan teknologi dengan manusia, kesihatan dan persekitaranPenampilan fizikal
Pepejal putih. Kristal ordorrombik putih atau coklat, bergantung pada tahap kekotoran.
Bau
Lavatory.
Takat lebur
280 ºC. Titik lebur ini, di bawah sebatian ionik yang lain, adalah kerana ia adalah garam dengan kation monovalen (+1) dan dengan ion penyamaran dalam saiznya, menyebabkan pepejal mempunyai tenaga retikular kristal yang rendah.
Kelarutan
76.4 g/100 g air pada 25 ° C. Hubungan ini untuk air adalah disebabkan oleh keupayaan besar molekul mereka untuk menyelesaikan ion ammonium. Sebaliknya, ia tidak larut dalam aseton dan alkohol; iaitu, dalam pelarut kutub yang kurang daripada air.
Ketumpatan
1.77 g/cm3 pada 25 ºC.
Tekanan wap
1,871 kPa pada 20 ºC.
Titik kilat
26 ºC.
Ph
5.0 - 6.0 (25 ºC. penyelesaian 1 m). PH sedikit berasid adalah disebabkan oleh hidrolisis NH4+ Di dalam air, menghasilkan h3Sama ada+ pada kepekatan rendah.
Kestabilan
Stabil dalam keadaan persekitaran yang mencukupi. Bersentuhan dengan oksidan yang kuat ia dapat membakar.
Penguraian
Ia mula terurai pada 150 ºC, melepaskan sulfur oksida toksik, nitrogen oksida dan ammonium.
Kakisan
Tidak menyerang besi atau aluminium.
Penggunaan ammonium sulfat
Dalam pertanian
- Ammonium sulfat digunakan sebagai baja di tanah alkali. Garam ammonium mempunyai 21 % nitrogen dan 24 % sulfur dalam komposisinya. Walau bagaimanapun, terdapat sebatian yang memberikan jumlah nitrogen yang lebih besar daripada ammonium sulfat; Kelebihan yang terakhir adalah kepekatan sulfur yang tinggi.
- Sulfur sangat penting dalam sintesis protein, kerana beberapa asid amino - seperti sistin, metionin dan sistein - mempunyai sulfur. Atas sebab ini, ammonium sulfat terus menjadi salah satu baja yang paling penting.
- Ia digunakan dalam gandum, jagung, nasi, kapas, kentang, rami dan tanaman buah -buahan.
- PH tanah alkali turun untuk sumbangan mereka dalam proses nitrifikasi yang dijalankan oleh mikrob. Ammonium digunakan (NH4+) untuk menghasilkan nitrat (tidak3-) dan lepaskan h+: 2nh4+ + Ke -42 => 2no3- + 2h2O + 4H+. Peningkatan kepekatan hidrogen mengurangkan pH tanah alkali dan membolehkan lebih banyak penggunaan.
- Sebagai tambahan kepada penggunaannya sebagai baja, ammonium sulfat bertindak sebagai pembantu insektisida larut, herbisida dan racun fungisida, yang disembur pada tanaman.
- Sulfat mampu menculik ion yang terdapat di dalam tanah dan air pengairan yang diperlukan untuk kehidupan patogen tertentu. Antara ion yang ditangkap ammonium sulfat adalah CA2+, Mg2+, iman2+ dan iman3+. Tindakan ini meningkatkan kesan mikrobisida dari ejen -ejen yang disebutkan di atas.
Sebagai reagen analisis
Ammonium sulfat bertindak sebagai ejen pencetus dalam analisis elektrokimia, di tengah -tengah budaya mikrobiologi dan dalam penyediaan garam ammonium.
Dalam pemendakan dan penebat protein
Ammonium sulfat digunakan dalam penebat dan pemurnian protein, terutama plasma. Kepada plasma jumlah ammonium sulfat ditambah untuk membawanya ke kepekatan tertentu; Oleh itu, pemendakan kumpulan protein disebabkan.
Precipitate oleh sentrifugasi dikumpulkan dan supernatan ditambahkan jumlah tambahan ammonium sulfat dan, kepada kepekatan baru, pemendakan kumpulan protein yang lain dihasilkan.
Pengulangan proses sebelumnya secara berurutan membolehkan mendapatkan pecahan protein plasma yang berbeza.
Sebelum teknologi baru biologi molekul muncul, prosedur ini membenarkan penebat protein plasma yang sangat penting dalam bidang perubatan, contohnya: immunoglobulin, faktor pembekuan, dll.
Dalam industri
Ammonium sulfat bertindak dengan melambatkan permulaan kebakaran dalam industri tekstil. Ia digunakan sebagai bahan tambahan dalam industri elektroenchapado. Ia juga digunakan dalam pengeluaran hidrogen peroksida, ammonium klorida, dll.
Kegunaan lain
- Ammonium sulfat digunakan sebagai agen pengawalseliaan tekanan osmotik dan sebagai ejen garam precipitating.
- Dalam bentuk ammonium sulfat lauril, ia mengurangkan ketegangan permukaan air, dengan itu membolehkan pemisahan bahan pencemar dengan peningkatan kekerasan air.
- Adalah ejen antikorrosif.
- Ia digunakan sebagai bahan tambahan makanan yang mengawal keasidan dalam adunan tepung dan roti.
- « Konsep Misi dan Penglihatan Peribadi, Cara Melakukannya, Contohnya
- Kemudian garam apa, nomenclature, sifat, contoh »