Kalsium sulfat (Case4) Struktur Kimia, Hartanah, Kegunaan
- 2707
- 645
- Kerry Schmitt
Apa itu kalsium sulfat?
Dia Kalsium sulfat Ia adalah garam ternary kalsium, logam alkalinother (MR. Scholambara), belerang dan oksigen. Formula kimianya adalah kes4, Yang bermaksud bahawa bagi setiap kation ca2+ ada anion begitu42- Berinteraksi dengan ini. Membentuk sebatian dengan pengedaran yang luas.
Bentuk yang paling banyak adalah kes4· 2h2Atau (plaster) dan kes bentuk anhydrous4 (Anhydrite). Terdapat juga bentuk ketiga: plaster atau plaster Paris, yang dihasilkan oleh pemanasan plaster (hemidrate, kes4· 1/2H2Sama ada).
Kalsium sulfat adalah sebatian yang sangat berguna dalam kerja manusia, kerana ia digunakan dalam pelbagai fungsi yang termasuk pembinaan jalan, kediaman rumah dan juga pembaikan tulang.
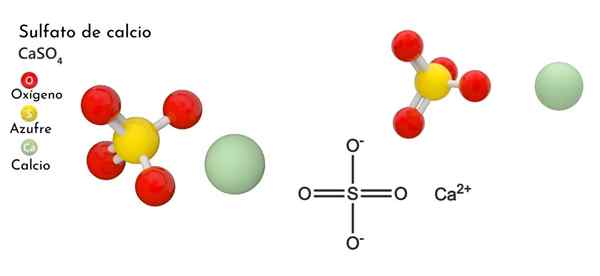
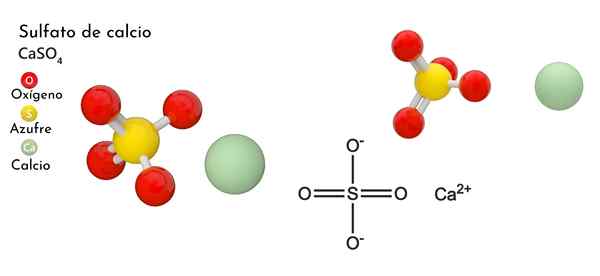
Struktur kimia kalsium sulfat

Di bahagian atas, sel kesatuan ortorrombik ditunjukkan untuk kes itu4. Di sini diandaikan bahawa interaksi adalah semata -mata elektrostatik; iaitu, bahawa2+ Mereka menarik anion tetrahedral jadi42-.
Walau bagaimanapun, CA2+ Sangat mudah untuk menyelaraskan, membentuk struktur polyhedral di sekelilingnya. Untuk apa ini? Kepada ketersediaan kalsium elektronik untuk menerima elektron spesies asas atau negatif (seperti atom O SO42-).
Memandangkan titik sebelumnya, sekarang ion -ion2+ Mereka menerima pautan datif (disediakan oleh O) dan sel unit diubah, seperti yang ditunjukkan oleh imej yang lebih rendah:
Akibatnya, polyhedro Cao terbentuk8 (Lingkaran hijau CA2+ dikelilingi oleh lapan sfera merah atau tetrahedra begitu4 Tutup). Kalsium polyhedros dan sulfat tetrahedra; Ini adalah struktur kristal kes itu4 anhydrous.
Ia dapat melayani anda: Bipe Beraral: Apa, Ciri -ciri, Apa Itu UntukDi samping itu, apabila kristal terhidrasi -membentuk garam di -hidrasi atau hemidrate (kes4· 1/2 h2O)- Struktur ditunda untuk menggabungkan molekul air.
Molekul -molekul ini boleh diselaraskan dan diselaraskan dengan kalsium; iaitu, mereka menggantikan satu atau dua kumpulan sulfat.
Sebaliknya, tidak semua air terus mengintegrasikan polyhedron CAO8. Ada, sebaliknya, membentuk jambatan hidrogen dengan sulfat. Ini berfungsi sebagai kesatuan untuk dua bahagian di zigzag, produk susunan ion di kaca.
Ciri -ciri kalsium sulfat
 Penampilan kalsium sulfat
Penampilan kalsium sulfat Formula molekul
Case4 · NH2O.
Berat molekul anhydrous
136,134 g/mol.
Bau
Ia adalah tandas.
Aspek
Dalam kes anhydrite, ia kelihatan seperti serbuk pepejal ortorrombik atau monoklinik putih. Kristal adalah warna yang berubah -ubah: mereka boleh menjadi putih atau dengan pewarna kebiruan, kelabu, atau kemerahan; Ia juga boleh menjadi batu bata merah.
Ketumpatan
2.96 gr/cm3 (bentuk anhydrous). 2.32 gr/cm3 (bentuk dihydrate).
Takat lebur
1450 ºC (2840 ºF). Ciri -ciri interaksi elektrostatik yang kuat antara ion divalen CA2+ Dan juga42-.
Kelarutan
0.2-0.3 % dalam air pada 25 ° C. Ia sedikit larut dalam air dan tidak larut dalam etanol.
Kestabilan
Stabil pada suhu bilik.
Penggunaan kalsium sulfat
Dalam pembinaan dan seni
Ia digunakan dalam penjelasan stuko ke Frisar dinding rumah dan pembinaan lain yang menyumbang kepada pengindahannya. Di samping itu, acuan media dibuat di bumbung dan bingkai tingkap. Plaster juga berada di langit tergesa -gesa.
Kalsium sulfat digunakan untuk membantu menyelesaikan masalah yang berlaku dalam penghidratan konkrit, sehingga bekerjasama dalam pembinaan jalan, jalan, dll.
Ia boleh melayani anda: Electrophil: Reaksi, Contoh, ElektrofilitiDengan plaster, patung -patung diuraikan, terutama tokoh agama, dan di tanah perkuburan mereka digunakan di batu nisan.
Terapeutik
Doktor haiwan
Secara eksperimen, kepingan kalsium sulfat steril telah digunakan dalam doktor haiwan untuk membaiki kecacatan tulang atau rongga, seperti yang ditinggalkan oleh luka atau tumor.
Plaster atau Plaster Paris boleh digunakan untuk membaiki kecacatan tulang untuk keupayaan unik mereka untuk merangsang osteogenesis. Kajian X -ray dan Technecium (TC99m) Medronate.
Penjanaan tulang telah ditunjukkan dalam enam anjing dalam tempoh 4 hingga 6 bulan. Kalsium sulfat mula digunakan dalam bidang ini pada tahun 1957, dalam bentuk tablet plaster Paris, dapat mengisi tulang anjing.
Penggantian tulang kalsium sulfat adalah setanding dengan yang diperhatikan dalam tulang autogenik.
Ruhaimi (2001) menggunakan kalsium sulfat dalam tulang rahang arnab yang baru dimusnahkan, memerhatikan peningkatan osteogenesis dan pengkalsifikasi tulang.
Ubat
Kalsium sulfat digunakan dalam bidang perubatan untuk melancarkan sendi yang telah mengalami dislokasi dan tulang patah, selain digunakan sebagai excipient dalam penjelasan tablet.
Odontologi
Dalam pergigian ia digunakan sebagai asas untuk menghuraikan prostesis pergigian, dalam pemulihan dan tanggapan gigi.
Dalam penjelasan makanan
Ia digunakan sebagai koagulan dalam penjelasan tauhu, makanan yang dibuat dengan soya dan penggunaan yang hebat di negara -negara timur sebagai pengganti daging. Di samping itu, ia telah digunakan sebagai reaffirmant makanan dan dalam rawatan tepung.
Boleh melayani anda: alotropiSebagai baja dan perapi tanah tanaman
Plaster (kes4· 2h2O) Ia digunakan sebagai baja di Eropah sejak 18.
Kalsium mesti disediakan untuk akar tumbuhan untuk bekalan yang mencukupi. Kemudian, penambahan kalsium meningkatkan tanaman hortikultur dan kacang tanah (kacang tanah).
Rotan akar kacang yang dihasilkan oleh patogen biologi, serta reput apikal tembikai dan tomato, sebahagiannya dikawal dengan aplikasi plaster pertanian.
Plaster membantu mengurangkan penyebaran tanah liat, menyebabkan pembentukan kudung di tanah. Dengan mengurangkan kudis yang terbentuk di atas tanah, plaster memudahkan keluar anak benih. Ia juga meningkatkan kemasukan udara dan air ke tanah.
Plaster membantu memperbaiki tanah dengan mengurangkan keasidan dan ketoksikan aluminium, dengan itu menyesuaikan tanaman untuk tanah natrium.
Dalam pengeluaran sebatian lain
Kalsium sulfat bertindak balas dengan ammonium bikarbonat untuk membentuk ammonium sulfat. Ia juga telah digunakan dalam proses pengeluaran asid sulfurik.
Ashidro Calcium Sulfate dicampur dengan syal atau kurus dan, apabila campuran dipanaskan, sulfur trioksida dibebaskan. Sulfur oksida adalah prekursor asid sulfurik.