Mekanisme dan contoh penggantian elektrofilik aromatik

- 2683
- 506
- Ms. Edgar Carroll
The Penggantian elektrofilik aromatik (Sear) Ia adalah tindak balas organik di mana spesies miskin dalam elektron, iaitu, elektrofi, menggantikan salah satu hidrogen cincin aromatik. Reaksi ini menentang penambahan yang dialami oleh alkenes, menunjukkan kesan aromatik terhadap reaktiviti benzena dan derivatifnya.
Elektrofil, berkali -kali, dihasilkan semasa mekanisme molekul yang sama, produk campuran reagen dan pemangkin, yang terdiri daripada asid Lewis, contohnya semua3 atau FECL3. Pemangkin ini meningkatkan kekejaman elektrofil oleh elektron cincin aromatik, dengan itu mempercepat reaksi.
 Dalam penggantian elektrofilik aromatik, cincin benzena yang menyerang elektrofil. Sumber: Gabriel Bolívar melalui Molview.
Dalam penggantian elektrofilik aromatik, cincin benzena yang menyerang elektrofil. Sumber: Gabriel Bolívar melalui Molview. Dalam imej yang unggul kita mempunyai perwakilan mudah serangan elektrofilik benzena ke arah elektrofil dan+. Perhatikan bahawa serangan itu datang dari elektron salah satu ikatan gandanya; iaitu, ia adalah elektron sistem π konjugasi yang memulakan sear.
Reaksi ini memungkinkan benzena dan sebatian aromatik lain untuk memperoleh substituen seperti kumpulan OH, tidak2, SW3H, CL, BR, R, COR, COCH3, dalam kalangan yang lain. Sebagai contoh, fenol disintesis melalui Sear bermula dari benzena dan derivatif lain.
[TOC]
Mekanisme penggantian elektrofilik aromatik
Langkah 1: Serangan Elektrofilik
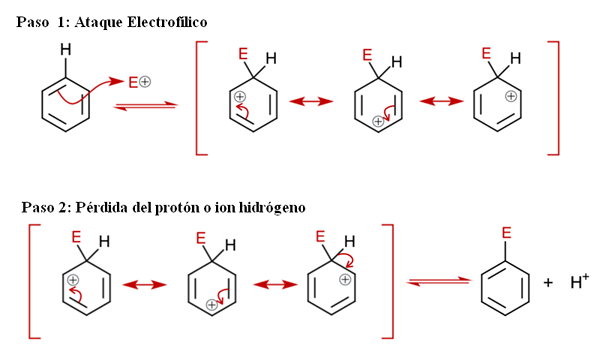 Mekanisme umum untuk sear. Sumber: Soonlorpai melalui Wikipedia.
Mekanisme umum untuk sear. Sumber: Soonlorpai melalui Wikipedia. Dalam imej unggul, mekanisme penggantian elektrofilik aromatik diwakili dengan lebih terperinci. Mana -mana tiga ikatan ganda benzena menyerang elektrofil dan+, Untuk membentuk spesies perantara yang dikenali sebagai ion arenio (cyclohexadien delocalized), terkunci dalam kurungan merah.
Boleh melayani anda: pemendakan kimiaPerhatikan bahawa beban positif e+ Sekarang bergerak ke pedalaman cincin. Tetapi bukan hanya itu: ia berpindah antara tiga atom karbon dalam kedudukan ortho (bersebelahan) dan untuk (bertentangan) ke karbon yang dikaitkan dengan E (c-e). Perantara ini wujud dengan tepat terima kasih kepada kestabilan yang diberikan oleh struktur resonansinya.
Langkah 2: Kehilangan ion proton atau hidrogen
Walau bagaimanapun, ion arenio mesti meneutralkan beban positifnya dengan kehilangan proton hidrogen atau ion. Di sinilah penggantian memuncak. Electrophil e+ oleh itu menggantikan salah satu hidrogen benzena, meninggalkan ini sebagai ion h+ di luar cincin, jadi caj positif dipelihara.
Sekiranya diperhatikan dengan teliti, semua langkah berada dalam keseimbangan, jadi penggantiannya boleh diterbalikkan. Iaitu, jika kepekatan H meningkat+, Kemudian hidrogen akan menggantikan E dan kami akan mendapatkan reagen lagi.
Contoh penggantian elektrofilik aromatik
Benzena
Benzene Sear adalah yang paling mudah dari semua, sudah diwakili di atas. Mana -mana hidrogen boleh digantikan oleh e+, Kerana semuanya bersamaan secara kimia.
Tidak ada perbezaan antara satu sama lain. Oleh itu, kebarangkalian bahawa penggantian berlaku di salah satu daripada enam atom karbon adalah sama. Walau bagaimanapun, semuanya berubah apabila terdapat substituen lain yang terdapat di cincin benzenik, seperti yang akan kita lihat di bawah.
Phenol
Ortho, untuk dan serangan gol
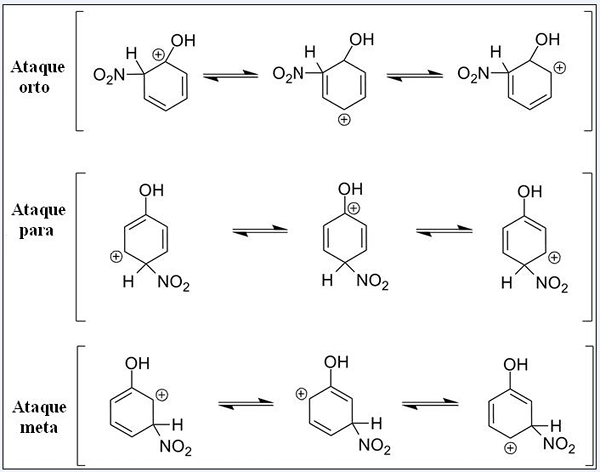 Struktur resonans untuk fenol dalam tindak balas penggantian elektrofilik aromatiknya. Sumber: Pete Davis, Domain Awam, melalui Wikimedia Commons
Struktur resonans untuk fenol dalam tindak balas penggantian elektrofilik aromatiknya. Sumber: Pete Davis, Domain Awam, melalui Wikimedia Commons Pertimbangkan sekarang sear untuk fenol. Kali ini, elektrofi adalah kation Nitronian, tidak2+, yang ketika menghubungkan ke cincin benzena diubah menjadi kumpulan nitro, -no2.
Boleh melayani anda: nitrat: sifat, struktur, tatanama, latihanSekarang kumpulan OH hadir, hidrogen lain berhenti bersamaan dengan kimia; Ada yang lebih mudah diganti daripada yang lain. Dan di samping itu, OH memberi pengaruh langsung pada ketika ini.
Up kami mempunyai tiga penggantian dalam kedudukan yang berbeza yang berkaitan dengan OH: ORTHO ATTACKS, FOR dan GOOW. Perhatikan bahawa dalam ketiga -tiga kita mempunyai kation berpasir dan struktur resonansinya. Dalam serangan ortho dan untuk, beban positif di dalam cincin benzena terletak betul -betul di karbon yang dikaitkan dengan OH; Semasa dalam serangan sasaran, ini tidak berlaku.
Oh sebagai kumpulan ortho dan pengarah
Oh membentangkan keupayaan untuk menghasilkan elektron ke cincin melalui resonans dan induksi. Pada kedua -duanya, ia dapat membantu "menghilangkan" beban positif dalam karbon yang mana ia dikaitkan, menstabilkan strukturnya. Sebaliknya, apabila serangan sasaran berlaku, OH tidak dapat menstabilkan beban positif dengan cara yang sama, strukturnya lebih tidak stabil.
Oleh itu, serangan ortho dan lebih banyak tenaga disukai. Kemudian dikatakan bahawa Oh adalah kumpulan pengarah ortho-untuk, yang juga boleh mengaktifkan cincin benzenik ke arah sear. Iaitu, fenol bertindak balas lebih cepat daripada benzena, yang ditunjukkan dengan mengukur kelajuan tindak balas.
Arilamine
 Struktur resonans untuk aniline dalam tindak balas penggantian elektrofilik aromatiknya. Sumber: V8rik di Bahasa Inggeris Wikipedia, CC BY-SA 3.0, melalui Wikimedia Commons
Struktur resonans untuk aniline dalam tindak balas penggantian elektrofilik aromatiknya. Sumber: V8rik di Bahasa Inggeris Wikipedia, CC BY-SA 3.0, melalui Wikimedia Commons Kes arilamin, seperti aniline (imej unggul), adalah serupa dengan fenol. Perhatikan bahawa dalam mekanisme kali ini penstabilan beban positif pada atom nitrogen (h2N+=), membantu penggantian berorientasikan ke arah kedudukan ortho dan untuk, seperti OH.
Ia boleh melayani anda: Teori-Bass Teori: Arrhenius, Bronsted-Lowry, LewisSekarang, aniline lebih reaktif daripada fenol terhadap penggantian elektrofilik. Kerana? Kerana atom nitrogen kurang elektronegatif daripada oksigen, itulah sebabnya ia memberikan pasangan elektron bebas lebih mudah ke cincin aromatik. Oksigen, kerana ia lebih elektronegatif, menghasilkan salah satu pasangan elektronnya dengan kurang "kekejaman".
Juga, jejari atom nitrogen lebih dekat dengan karbon. Ini memberi kesan kepada hakikat bahawa resonans berlaku terutama antara atom dengan radio atau saiz yang sama. Oleh itu, resonans antara karbon dan nitrogen sedikit lebih stabil dan efisien daripada yang antara karbon dan oksigen.
Chlorobenzene
Di Chlorobenzene, sebaliknya, atom CL melambatkan penggantian kerana elektronegativitynya. Dan walaupun ia juga dapat menderma elektron akibat resonans ke cincin, jejari atomnya jauh lebih besar daripada karbon, oleh itu penurunan sumbangan elektronik.
Sebagai tindak balas, chlorobenzene bertindak balas 50 kali lebih perlahan daripada benzena, kerana cincinnya dinyahaktifkan kerana klorin. Dan juga, menarik elektron ke arah dirinya sendiri, klorin adalah kumpulan sasaran, jadi penggantian akan berlaku terutamanya dalam kedudukan itu.
Rujukan
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (10th Edisi.). Wiley Plus.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Morrison dan Boyd. (1987). Kimia organik. (Edisi Kelima). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Sebatian aromatik. Diperoleh dari: dalam.Wikipedia.org
- Ed Vitz et al. (8 September 2020). Hidrokarbon aromatik. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Wyman Elizabeth. (2020). Hidrokarbon Aromatik: Definisi, Contoh & Penggunaan. Kajian. Pulih dari: belajar.com
- Boluda, c. J., Macías, m., & González Marrero, J. (2019). Kerumitan kimia petrol automotif. Sains, kejuruteraan dan aplikasi,2(2), 51-79. Doi: doi.org/10.22206/Cyap.2019.V2i2.PP51-79
- « Ciri -ciri Tenaga Termal, Mendapatkan, Pemindahan
- Struktur, sifat, kegunaan, penggunaan oksida aluminium »

