Teori Orbital Molekul

- 3265
- 720
- Horace Gulgowski
Apakah teori orbital molekul?
The Teori Orbital Molekul (TOM) Ia adalah model matematik yang dibangunkan untuk menerangkan sifat -sifat fizikokimia molekul, seperti penyerapan dan pelepasan radiasi, kekonduksian elektrik, serta sifat elektronik hubungannya. Ini menganggap, tidak seperti teori pautan valencia (TEV), bahawa elektron dipindahkan ke seluruh molekul, tanpa terletak secara probabilistik di pautan.
Oleh itu, teori orbital molekul menggunakan prinsip kuantum yang sama yang menentukan fungsi gelombang untuk orbital atom, dengan itu menggambarkan keadaan tenaga elektron dalam atom; Hanya sekarang, menangani orbital molekul yang dipanggil, berasal dari kombinasi linear orbital atom atom yang dikaitkan.
 Paramagnetisme oksigen cecair, dan oleh itu tarikannya untuk magnet, dijelaskan terima kasih kepada teori orbital molekul. Sumber: Pieter Kuipeper melalui Wikipedia.
Paramagnetisme oksigen cecair, dan oleh itu tarikannya untuk magnet, dijelaskan terima kasih kepada teori orbital molekul. Sumber: Pieter Kuipeper melalui Wikipedia. Teori orbital molekul berfungsi kemudian, bekerja dengan orbital molekul, pengagihan elektronik dan spatial mereka, serta gambar rajah tenaga masing -masing, yang membolehkan memerhatikan jurang tenaga yang memisahkannya. Di atas semua, menerangkan paramagnetisme bahan -bahan tertentu, seperti oksigen molekul dalam keadaan cair (lihat di atas).
O2, Diterangkan oleh struktur Lewis dan teori pautan Valencia, ia mempunyai semua elektron yang berpasangan, jadi dalam teori ia harus diamagnetik. Walau bagaimanapun, dalam praktiknya telah ditunjukkan bahawa ia sebenarnya paramagnet, iaitu, ia telah hilang elektron; secara khusus sepasang elektron yang hilang.
Dari pembinaan rajah OM (orbital molekul) untuk O2, Molekul diatomik homonuklear, dapat dilihat bahawa akan ada dua elektron yang hilang dengan tinggi. Bukan sahaja ini, tetapi putaran dan kedudukan elektron -elektron ini di OMS juga menjelaskan keadaan elektronik lain atau2 (bujang).
Lain -lain kejayaan yang paling penting dalam teori orbital molekul adalah bahawa ia membantu meramalkan kemungkinan kewujudan molekul diatomik, serta kestabilan relatif mereka. Oleh itu, teori orbital molekul betul dalam ramalan molekul seperti b2 dan li2, Walaupun mereka hanya dapat mengesan fasa wap pada suhu tinggi. Juga, teori ini menolak kewujudan hipotesis yang saya ada2 atau ne2.
Jenis ikatan molekul dan orbital
Seperti teori pautan Valencia, dalam teori orbital molekul, beberapa jenis pautan dianggap bergantung kepada arah arah tumpang tindih orbital atom yang mengambil bahagian dalam ikatan kimia. Antara yang paling penting dan sekarang dalam sifat molekul, kita mempunyai ikatan sigma dan pi.
Sigma
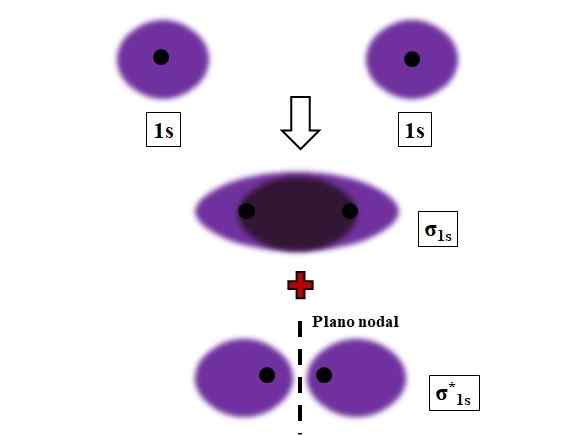 Pembentukan pautan σ1s dan σ1s* semasa pertindihan dua orbital atom 1s. Sumber: Gabriel Bolívar.
Pembentukan pautan σ1s dan σ1s* semasa pertindihan dua orbital atom 1s. Sumber: Gabriel Bolívar. Sigma, σ ikatan ditubuhkan apabila orbital atom bertindih secara depan, berhubung dengan kapak internuclear khayalan.
Pertimbangkan, sebagai contoh, pautan σ yang dibentuk apabila dua orbital atom 1S, mengikut atom hidrogen, hampir dengan jarak yang sangat pendek (imej di atas). Kerana orbital 1s adalah simetri, tumpang tindih mereka akan sentiasa menjadi frontal; Oleh itu, mereka akan sentiasa menjana orbital molekul σ1s dan σ1s*.
Perhatikan sekarang bahawa orbital molekul σ1s menunjukkan ketumpatan elektronik tertumpu di ruang yang memisahkan kedua -dua nukleus. Ini bermaksud bahawa dalam orbital σ1s Kebarangkalian mencari elektron adalah maksimum di rantau ini molekul. Elektron σ1s Mereka dipindahkan ke seluruh ruang yang meliputi warna ungu.
Sebaliknya, di orbital σ1s* Kami mempunyai satah nod antara kedua -dua nukleus. Ini bermakna kebarangkalian mencari elektron antara ruang itu sama dengan sifar. Perhatikan bahawa dalam orbital σ1s* Elektron menggambarkan kedudukan di sekitar setiap dua nukleus; tidak di sekitar molekul secara keseluruhan.
Boleh melayani anda: radio: struktur, sifat, kegunaan, mendapatkanPi
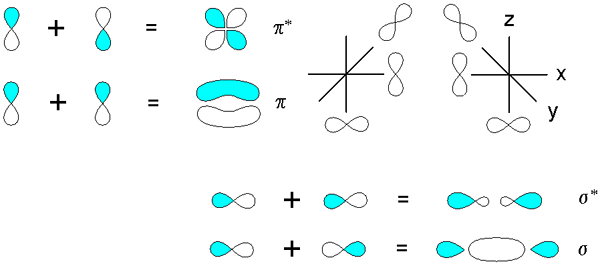 Ikatan sigma dan pi yang diperolehi daripada pertindihan orbital p. Sumber: v8rik di dalam.Wikipedia, CC oleh-SA 3.0, melalui Wikimedia Commons
Ikatan sigma dan pi yang diperolehi daripada pertindihan orbital p. Sumber: v8rik di dalam.Wikipedia, CC oleh-SA 3.0, melalui Wikimedia Commons Pertimbangkan sekarang ikatan molekul dan orbital. Ini berlaku apabila tumpang tindih orbital berlaku dalam arah yang berserenjang dengan paksi internuclear, yang sewenang -wenangnya tetap di mana -mana paksi pesawat Cartesian. Dengan mengandaikan kita bercakap mengenai orbital 2px, Orbital 2pdan Ia akan bebas untuk menubuhkan pautan PI (lihat lobus biru dan putih).
Apabila dua orbital 2pdan Dua orbital molekul berasal: π2py dan π2py*; Yang pertama mempunyai ketumpatan elektronik tertinggi dan di bawah paksi internuclear, sementara yang kedua menyerupai bunga empat -petal, di mana kebarangkalian mencari elektron jauh lebih rendah.
Sebaliknya, orbital 2p, untuk mengatakan 2px, Mereka juga boleh bertindih secara depan untuk berasal dari ikatan σ dan dua orbital molekul σ2px dan σ2px*. Seperti dalam kes σ1s dan σ1s*, Orbital σ2px menunjukkan ketumpatan elektronik yang lebih besar antara kedua -dua nukleus; yang bertentangan dengan σ2px*, di mana elektron berorientasikan ke arah sisi luar.
Pautan
Orbital molekul yang mengalir adalah yang menyumbang kepada kestabilan molekul. Iaitu, mereka mesti mempunyai tenaga yang kurang berbanding dengan orbital atom atom individu sebelum menghubungkan dan membentuk molekul. Di orbital ini, elektron dipindahkan oleh semua dimensi molekul secara keseluruhan.
Dalam gambar rajah OM, ini akan sentiasa terletak di bawah orbital atom yang digabungkan untuk membentuknya. Ini akan dilihat dengan lebih terperinci di bahagian seterusnya.
Anti -hut
Orbital molekul anti -housing, sebaliknya, adalah mereka yang menjejaskan molekul. Mereka dilambangkan dengan asterisk (*), dan tenaga mereka lebih tinggi daripada orbital atom yang berasal dari mereka. Di orbital ini, elektron dipindahkan agak tidak teratur, seolah -olah molekul itu dipecah secara elektronik.
Dalam gambar rajah OM, mereka akan sentiasa terletak di atas orbital atom yang digabungkan untuk membentuknya.
Tidak dihubungkan
Sementara itu, orbital yang tidak menghubungkan, serta elektron mereka, adalah mereka yang tidak menyumbang atau membahayakan kestabilan molekul. Tenaga beliau sangat serupa dengan orbital atom.
Pesanan pautan
Perintah pautan menjadi dalam teori orbital molekul, seperti nombor pautan dalam teori pautan Valencia: ukuran daya pautan dalam molekul. Oleh itu, pesanan pautan sama dengan 1 sepadan dengan pautan mudah (-). Dan pesanan pautan (atau.e) sama dengan 2, sepadan dengan ikatan berganda (=). Jadi pada.
Perintah ini ditentukan dari pengiraan elektron dalam rajah OM untuk molekul tertentu. Untuk melakukan ini, formula berikut mesti digunakan:
Sama ada.E = (bilangan elektron yang dipautkan - bilangan elektron anti -hut)/2
Elektron pautan menyumbang kepada molekul untuk menstabil. Oleh itu, lebih banyak elektron anti -sung, semakin kecil atau.E, dan molekul akan cenderung sangat tidak stabil. Apabila o.E sama dengan 0, ini bermakna bahawa molekul tidak wujud (atau sekurang -kurangnya dalam teori).
Rajah om
Dalam rajah OM, tenaga orbital molekul diwakili, dan pengisian elektroniknya juga divisualisasikan, yang mematuhi peraturan Aufbauf dan Sinn, serta prinsip pengecualian Pauling. Pertimbangkan, sebagai contoh, dua rajah berikut:
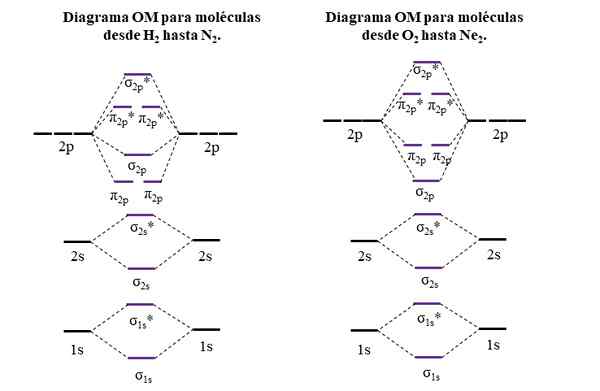 Rajah om untuk molekul tempoh pertama dan kedua dalam jadual berkala. Sumber: Gabriel Bolívar.
Rajah om untuk molekul tempoh pertama dan kedua dalam jadual berkala. Sumber: Gabriel Bolívar. Garis mendatar di sisi, hitam, mewakili tenaga orbital atom. Sebaliknya, garis mendatar tengah, ungu, adalah tenaga orbital molekul. Perhatikan bagaimana OMS menghubungkan dan anti -agen diedarkan (*) berhubung dengan orbital atom atom individu.
Ia boleh melayani anda: kumpulan amino (NH2): struktur, sifat, contohPerhatikan juga bahawa dalam rajah yang betul, om σ2 p Mereka menukar tempat dengan π2 p. Ini berlaku dengan molekul o2, F2, dan ne hipotesis2.
Contoh
Dalam contoh berikut, OM akan meneruskan dengan elektron, mengira urutan pautan, dan membuat ramalan mengenai daya bon atau kestabilan molekul yang dipersoalkan.
H2
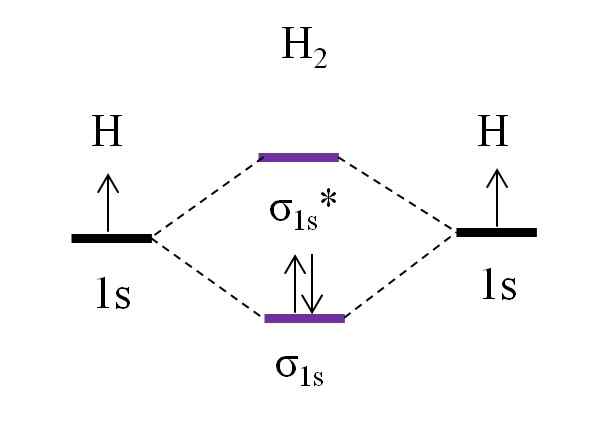 Rajah om untuk molekul dihydrogen. Sumber: Gabriel Bolívar.
Rajah om untuk molekul dihydrogen. Sumber: Gabriel Bolívar. Bermula dengan molekul yang paling mudah, iaitu dihydrogen, h2, Dua atom H dikaitkan dengan menggabungkan dua orbital atom 1s mereka untuk membentuk dua orbital molekul σ1s dan σ1s*. Kedua -dua elektron kemudian meneruskan untuk mengisi orbital molekul.
Pertama orbital σ diisi1s, Kerana ia adalah tenaga paling sedikit (peraturan aufbauf). Kemudian, elektron kedua mesti selesai mengisi orbital σ1s Sebelum memanjat orbital σ1s* (Peraturan sink). Dan akhirnya, elektron kedua ini membimbing putarannya ke arah yang bertentangan dengan elektron pertama (prinsip pengecualian Pauling). Oleh itu, kedua -dua elektron terletak di orbital yang dikaitkan σ1s.
Bagaimana dengan pesanan pautan? Dalam orbital molekul pautan σ1s Kami mempunyai 2 elektron; Semasa berada di orbital molekul anti -bela σ1s* Kami tidak mempunyai. Oleh itu, pengiraannya:
Sama ada.E = (2-0)/2
= 1
Menjadi atau.Dan sama dengan 1, ini bermakna bahawa pautan yang menyatukan dua atom hidrogen adalah mudah: H-H. Umumnya, jika nilai ini sama dengan atau lebih besar daripada 1, dikatakan bahawa molekul wujud dan stabil.
Dia2
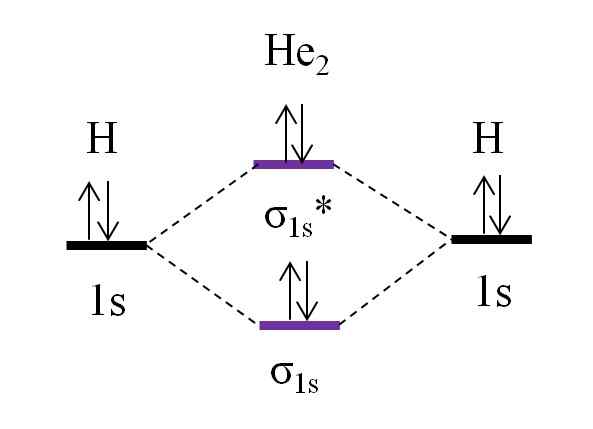 Om Diagram untuk Molekul Dihelio Hipotetikal. Sumber: Gabriel Bolívar.
Om Diagram untuk Molekul Dihelio Hipotetikal. Sumber: Gabriel Bolívar. Sekarang anggap anda mempunyai molekul dia2. Di atas kita melihat bahawa gambarajah omnya sangat serupa dengan h2, Dengan 2 elektron tambahan yang terletak di orbital σ1s*. Apabila terdapat sejumlah 4 elektron yang menambahkan kedua -dua atom, maka mesti ada 4 elektron dalam semua orbital molekul yang dihasilkan.
Menentukan o.E untuk saya dia2 kita akan mempunyai:
Sama ada.E = (2-2)/2
= 0
Ini bermaksud bahawa tidak ada pautan yang mungkin bahawa kedua -dua atom helium. Malah, setakat ini kewujudan molekul ini belum dikenal pasti, yang bersetuju dengan ramalan teori orbital molekul.
B2
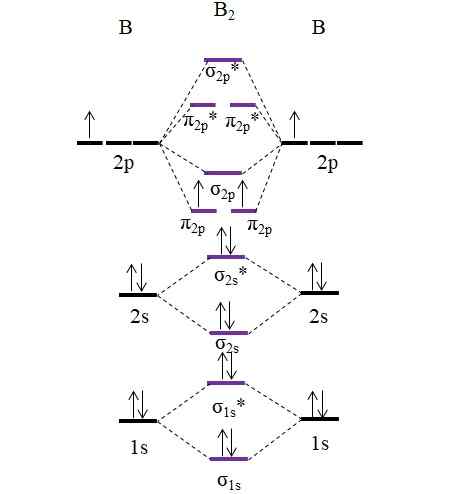 Rajah om untuk molekul b2. Sumber: Gabriel Bolívar.
Rajah om untuk molekul b2. Sumber: Gabriel Bolívar. Perhatikan bahawa dalam pembentukan orbital molekul, elektron lapisan dalaman juga diambil kira; Bukan sahaja di Valencia.
Oleh itu, dalam contoh molekul Diboro, b2, Setiap atom boron menyumbang 5 elektron secara keseluruhan, 3 daripadanya adalah dari Valencia; Ini adalah, orbital 2s dan 2p mereka. Kedua -dua elektron orbital 2p diposisikan dalam orbital molekul yang berbeza π2 p Dengan duri selari (peraturan sink).
Kami kemudian meneruskan untuk mengira pesanan pautan:
Sama ada.E = (6-4)/2
= 1
Oleh itu, molekul dijangka mempunyai pautan b-b sederhana. B2 Ia adalah molekul yang hanya wujud di peringkat stim pada suhu yang sangat tinggi, kerana boron dalam keadaan normal mengamalkan struktur dan reka bentuk rangkaian yang lebih kompleks.
C2 dan c22-
Pertimbangkan pertama gambarajah OM untuk molekul c2:
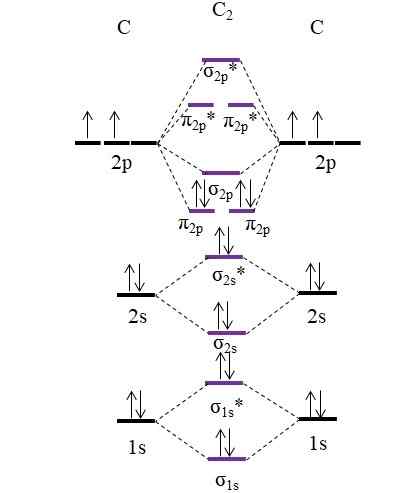 Rajah om untuk molekul c2. Sumber: Gabriel Bolívar.
Rajah om untuk molekul c2. Sumber: Gabriel Bolívar. Sekarang, dua elektron baru yang disediakan oleh atom karbon diposisikan lagi dalam orbital molekul π2 p Tetapi dengan putaran bertentangan (Pauling Exclusion Prinsip).
Menentukan pesanan pautan anda yang akan kami miliki:
Sama ada.E = (8-4)/2
= 2
Perhatikan bahawa orbital molekul π2 p Masukkan 4 ikatan elektron ke formula. Menjadi perintah ini sama dengan 2, ini bermakna molekul c2 Ia mempunyai ikatan berganda, c = c. Sekali lagi, molekul c2, Juga dipanggil karbon diatomik, hanya ada fasa stim pada suhu tinggi, dan ia adalah salah satu bentuk karbon allotropik yang paling mudah.
Dan bagaimana dengan c22-? Rajah OM anda adalah seperti berikut:
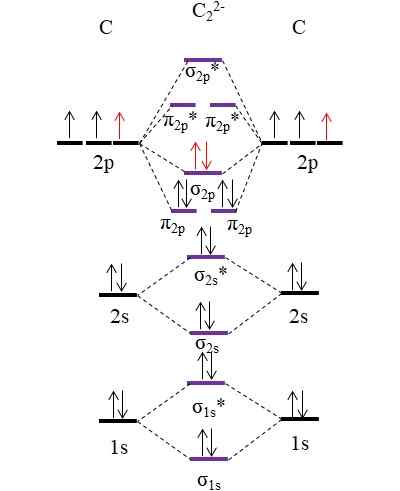 Rajah om untuk anion c22-. Sumber: Gabriel Bolívar.
Rajah om untuk anion c22-. Sumber: Gabriel Bolívar. Dua elektron baru (anak panah merah) diposisikan dalam menghubungkan orbital molekul σ2 p. Oleh itu, ini mengandaikan bahawa setiap atom karbon menyumbang salah satu daripada dua caj negatif (untuk keadaan pengoksidaan -1).
Boleh melayani anda: Mercury Fulminate: Struktur, sifat, mendapatkan, menggunakanMengira pesanan pautan anda yang akan kami ada:
Sama ada.E = (10-4)/2
= 3
Iaitu, anion c22-, Juga dipanggil anion acetyluro, ia mempunyai pautan triple, [c≡C]2-. Ia adalah anion yang agak stabil dengan daya pautan yang hebat; Walau bagaimanapun, bergantung kepada ion rakan sejawatnya, ia boleh berasal dari sebatian letupan.
N2 dan n2+
Molekul nitrogen yang terkenal, n2, Ia juga boleh diterangkan dengan sempurna dengan menggunakan rajah orbital molekul:
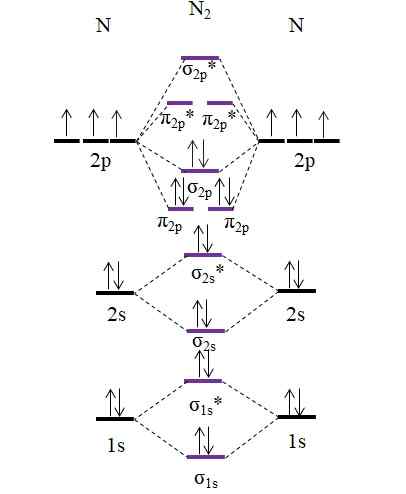 Rajah om untuk molekul n2. Sumber: Gabriel Bolívar.
Rajah om untuk molekul n2. Sumber: Gabriel Bolívar. Perhatikan bahawa rajah ini sama persis dengan anion c22-. Ini bermaksud bahawa n2 dan c22- Mereka adalah isolektronik. Walau bagaimanapun, fakta sedemikian tidak menyiratkan bahawa kedua -dua spesies berkelakuan dengan cara yang sama. N2, neutral, jauh lebih stabil daripada c22-, negatif, walaupun kedua -duanya mempunyai urutan pautan sama dengan 3, n≡N.
Dan bagaimana dengan kation n2+? Mari lihat rajah OM anda:
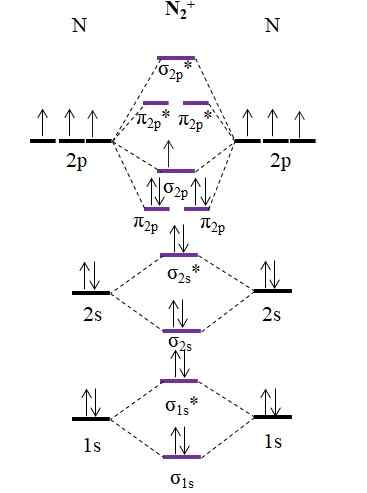 Rajah om untuk kation n2+. Sumber: Gabriel Bolívar.
Rajah om untuk kation n2+. Sumber: Gabriel Bolívar. Seperti kation n2+ Ia mempunyai satu elektron yang kurang, ini dikeluarkan σ molekul σ2 p. N2 Ia adalah diamagnet, sementara n2+ Ia adalah paramagnet. Dan perintah pautannya adalah:
Sama ada.E = (9-4)/2
= 2.5
Pautan 2 2.5 akan diwakili dengan dua baris dan satu titik. Walau bagaimanapun, perkara sedemikian tidak masuk akal dalam teori Valencia atau dalam struktur Lewis. Kerana pesanan pautan ini kurang dari 3, daya pautan yang ada di n2+ lebih rendah daripada n2, Jadi lebih tidak stabil.
Sama ada2, Sama ada22- I22+
Marilah kita melihat satu lagi molekul yang sangat penting untuk kehidupan: oksigen molekul atau diatomik, atau2. Menurut teori Valencia dan struktur Lewis, ia harus diamagnetik; Tetapi secara eksperimen ia telah ditunjukkan sebagai paramagnetik, jadi ia telah hilang elektron di suatu tempat.
Di bawah ini kita membandingkan gambar rajah OM untuk o2 dan ion atau22- (oksida) dan O22+ (Pengoksidaan):
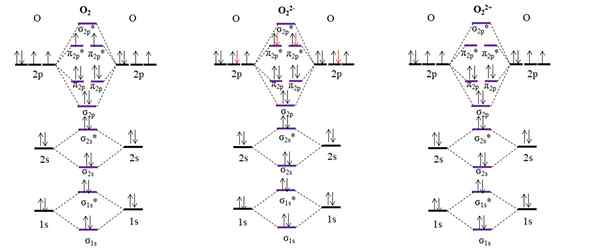 Rajah Om untuk oksigen molekul dan dua ion utamanya. Sumber: Gabriel Bolívar.
Rajah Om untuk oksigen molekul dan dua ion utamanya. Sumber: Gabriel Bolívar. Rajah om untuk o2 Contoh, tidak seperti yang sebelumnya, bahawa orbital molekul σ2 p dan π2 p Tukar kedudukan tenaga mereka. Juga, kita melihat dengan berkesan bahawa terdapat dua elektron yang hilang di orbital π2 p*, yang menerangkan watak paramagnetik oksigen (disebutkan pada permulaan artikel).
Sebaliknya, kami juga mempunyai rajah OM untuk anion atau22-, tersebar di alam semesta (bulan, planet, komet, asteroid, dll.). Ia mempunyai dua elektron tambahan (anak panah merah), yang selesai mengisi orbital π2 p*, mengawan semua elektron. Akibatnya, atau22- Ia adalah diamagnet.
Kami juga menganggap rajah OM untuk pengoksidaan atau22+. Ia mempunyai dua elektron kurang daripada o2, Meninggalkan kosong orbital π2 p*. Semua elektronnya dipasangkan, dan oleh itu ia adalah diamagnetic.
Pesanan pautan untuk O2, Sama ada22- I22+ Mereka masing-masing: 2 (O = O), 1 [O-O]2- dan 3 [O≡O]2+. Oleh itu, o22+ akan mempunyai pautan terkuat.
Kelebihan dan kekurangan
Kelebihan
Antara kelebihan teori orbital molekul kita dapat memetik yang berikut:
-Ia membolehkan untuk menilai pesanan pautan yang biasa tidak akan masuk akal dalam teori pautan valencia
-Ia berkorelasi dengan baik dengan diamagnetisme dan paramagnetisme molekul
-Jarak yang memisahkan orbital molekul dalam gambar rajah adalah sama dengan ΔE, dan berfungsi untuk menerangkan produk peralihan elektronik penyerapan foton
-Tidak hanya berlaku untuk molekul diatomik homonuklear, tetapi juga untuk molekul heteronuklear, seperti CO2 dan benzena
-Ia memanjangkan modelnya ke arah sebatian lain, seperti kompleks bukan organik, jadi ia menyokong teori bidang ligan
-Pertimbangan bahawa elektron dipindahkan ke seluruh molekul adalah mudah untuk menjelaskan banyak sifat fizikokimia
Kekurangan
Dan di antara beberapa kelemahan teori orbital molekul yang kita ada, untuk mengakhiri:
-Ia sangat abstrak dan memerlukan pemahaman matematik yang mendalam untuk memahaminya sepenuhnya
-Gambar rajah molekul sebagai co2, Co, h2Atau dan lain -lain, mereka boleh terlalu membosankan untuk menjelaskan dan menerangkan
-Dia tidak mengatakan apa -apa mengenai kawasan tertentu atau pautan molekul besar
-Ia juga tidak memberikan sebarang maklumat mengenai geometri molekul (satah trigonal, satah persegi, tetrahedral, dll.).
-Ia bukan grafik seperti teori pautan Valencia
Teori orbital molekul, kesimpulannya, adalah teori yang melengkapkan teori pautan Valencia untuk mempunyai panorama yang lebih luas dan lebih lengkap dari spektrum molekul.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Teori molekul orbital. Diperoleh dari: dalam.Wikipedia.org
- Stephen lebih rendah. (7 September 2020). Teori molekul orbital. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Steven a. Hardinger. (2017). Teori molekul orbital. Diperolehi daripada: Chemed.Chem.Purdue.Edu
- Buku tekan. (s.F.). Bab 8: Teori Molekul Orbital. Diperolehi dari: OpenTextBC.Ac

